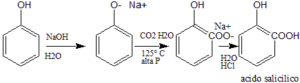GIOCHI DELLA CHIMICA 2016 FASE NAZIONALE CLASSE C
Settembre 20, 20241. Il gas AXn, riscaldato a 605 K, si dissocia parzialmente secondo la reazione:
AXn(g) → A(g) + n X(g)
Determinare l’indice “n” nella formula AXn, sapendo che 5,80 moli di gas si dissociano per il 35% e che all’equilibrio si ottengono nella miscela 11,89 moli complessive.
A) 2 B) 3 C) 4 D) 5
soluzione
per la reazione
AXn(g) → A(g) + n X(g)
5,8(1-α) 5,8α n 5,8 α
il numero di moli totali è 11,89 = 5,8(1-α) + 5,8α + n 5,8 α
11,89 = 5,8 –5,8α + 5,8α + n 5,8α
11,89 =5,8 + n 5,8α
ma α =0,35 quindi 11,89 -5,8 = n 2,03
pertanto n = 6,09/2,03 n=3
2. Un composto gassoso ha formula NxHy. 3,0 L del composto si decompongono totalmente producendo 1,0 L di N2 e 4,0 L di NH3 (a 341 K e 2,55 ·105 Pa). Determinare la formula del composto.
A) N2H3 B) N2H4 C) N3H6 D) N2H5
soluzione
calcoliamo le moli di N2 che si ottengono dall’equazione di stato dei gas PV=nRT n=PV/ RT
moli di N = 1 x 2,55 x 105 / 341 x 8,3144 89,95 moli N2
analogamente per l’NH3 si ha
moli di NH3 = 4 x 2,55 x 105 / 2835,2 = 359,8moli 359,8 x 17 = 6116,6 g NH3 359,8 moli NH3
89,9 moli di N2 cioè89,9 x 2 = MOLI DI N = 179,9 moli N
359,8 moli di NH3 cioè 359,8 moli di N e
le moli di idrogeno sono ottenute da
se in NH3 vi sono 3H in 359,8 ve ne sono X
X = 359,8 x3 moli di H = 359,8 moli N + 1079,4 di H
pertanto le moli di N (non di N2!!!) sono 359,8
le moli di H sono 1079,4
in totale gli atomi di AZOTO ottenuti sono:
179,9 provenienti da N2+ 359,8 provenienti da NH3= 539,7
Note le quantità di N e di H calcoliamo adesso la formula minima del composto:
dividiamo tutto per il numero più piccolo che è 539,7 ed abbiamo
539,8/539,8 =1 di N
1079,4 /539,7= 2 di H
nella molecola iniziale il rapporto più piccolo tra N ed H è 1:2 per cui la formula minima del composto è NH2 .
Per calcolare la formula del composto è necessario conoscere il suo Peso Molecolare e quindi
calcoliamo le moli iniziali del composto NxHy :
PV=nRT n=PV/RT
3 x 2,55 x 105/ 2835 = 7,65 x10-5 / 2835 = 2,698 x 10² = 269,8 moli di NxHy
che corrispondono a 269,8 x PM = grammi
Sappiamo inoltre, per la legge di conservazione della massa, che i
grammi di reagente (269,8 x PM) devono essere uguali alla somma dei grammi di prodotto ottenuto quindi
grammi di N2 = moli x PM = 89,95 x 28= 2518,6 g
grammi di NH3 = 359,8 x 17 = 6116,6 g
in totale i grammi di prodotto sono 8635,2
essi devono essere uguali alla massa del composto iniziale quindi
8635 = 269,8 x PM (grammi di composto iniziali)
da cui PM = 8635 /269,8= 32,0 g
Pertanto, essendo il rapporto minimo calcolato sopra NH2 cioè 16 g è evidente che la formula del composto iniziale è 2 NH2 cioè N2H4
risposta corretta B
3. ANNULLATA
Calcolare quante moli di NaOH occorre aggiungere a 0,34 moli di Na2HPO4 per preparare 1,0 L di soluzione acquosa a pH 12. Ka (Na2HPO4) = 3,6 ·10–13 A) 0,47 mol B) 0,25 mol C) 0,18 mol D) 0,31 mol
4. Stabilire quali sono le specie stabili in una soluzione 0,1 M in RuCl2 e 0,1 M in HClO4, conoscendo i potenziali delle semireazioni:
Ru2+(aq) + 2 e– →Ru (s) E° = + 0,45 V
Ru3+(aq) + e– → Ru2+(aq) E° = +0,249 V
A) Ru3+ (aq) e Ru (s)
B) Ru2+ (aq) e H+ (aq)
C) H2 (aq) e Ru3+ (aq)
D) Ru2+(aq) e Ru(s)
soluzione
dai potenziali redox sappiamo che HClO4
ClO4(-aq) + 2 H+(aq) + 2 e- ==> ClO3-(aq) + H2O E°= 1,19 V
quindi agisce da ossidante. L’elemento in soluzione che si ossida per primo è però l’Idrogeno ed in soluzione si sviluppa H2
5. ANNULLATA
La forma dissociata A– di un acido debole HA presenta uno spettro di assorbimento UV con un massimo a 245 nm, con un coefficiente di estinzione molare di 355,6 L mol–1 cm–1. HA → H+ + A– non assorbe assorbe a 245 nm Una soluzione 2,55 ·10–3 M dell’acido con pH = 4,56 mostra un’assorbanza a 245 nm di 0,233 unità in una cella di 1 cm. Determinare la costante acida di HA. A) 7,2 ·10–8 B) 9,5 ·10–6 C) 2,4 ·10–7 D) 6,9 ·10–4
6. Introducendo 173 g di un composto non volatile in 2,00 kg di acqua si ottiene una soluzione ideale che ha una tensione di vapore pari a 3,09 kPa a 25 °C. Qual è la massa molare del composto? La tensione di vapore dell’acqua a 25 °C è 3,17 kPa.
A) 40 g mol–1 B) 50 g mol–1 C) 60 g mol–1 D) 45 g mol–1
soluzione
in questo caso sappiamo che per la legge di Raoult si ha un abbassamento della tensione di vapore (che provoca un aumento del punto di ebollizione) per cui si ha
Psoluzione = P solvente x Frazione molare
Frazione molare solvente = Psoluzione / Psolvente = 3,09 / 3,17 = 0,9747
Fraz mol solvente = moli solvente / moli soluto + moli solvente
0,9747 = 2000/18 / moli soluto + 2000/18
0,9747 = 111,1 / moli soluto + 111,1
0,9747x(moli soluto + 111,1 ) = 111,1
0,9747 moli soluto + 108,28= 111,1
0,9747 moli soluto = 111,1 – 108,21
0,9747 moli soluto= 2,81
moli soluto = 2,81/0,9747 =2,88
173/PM= 2,88
PM = 2,88/ 173
PM = 60
risposta corretta C
7. Riducendo il volume di un sistema gassoso ideale, mantenendo la pressione fissa a 101,3 kPa, il sistema cede 20 kJ all’ambiente. Di quanto deve diminuire il volume perchè la temperatura del sistema non cambi?
A) 1970 cm3 B) 197 dm3 C) 197 m3 D) 19,7 dm3
soluzione
Q =ΔE + P(V2-V1)
se la temperatura deve rimanere costante allora ΔE =0
Q= P(V2-V1)
1 KJ = 1000 J e X = variazione di volume= V2-V1 (volume in litri ) quindi
20000 J = 101,3 X
X= 20000 J/101,3
X= 197,4 dm³ (o litri)
8. Aggiungendo 3,5 moli di una sostanza A non volatile in 1,0 kg di acqua, la temperatura di ebollizione dell’acqua diventa 101,5 °C. In soluzione acquosa, A è in equilibrio con il suo dimero A2. La costante ebullioscopica dell’acqua è 0,512°C kg mol–1. Il numero di moli di dimero presenti all’equilibrio nella soluzione è:
A) 0,12 mol B) 1,2 mol C) 0,6 mol D) 0,012 mol
soluzione
ΔT = Keb Molalità
1,5 /0,512=2,9 = molalità della soluzione.
che corrispondono a 2,9 moli di A in 1 Kg di acqua.
Tuttavia le moli iniziali di A erano 3,5 e se i dati corrispondono a 2,9 moli di A significa che le moli di A2 sono
3,5 -2,9 =0,6 moli A2
risposta corretta C
9. Per una reazione ΔG° è praticamente nullo, quindi può affermare che:
A) la reazione non avviene
B) una tale condizione non si può verificare
C) la costante di equilibrio della reazione è pari a 1
D) la costante di equilibrio della reazione è pari a zero
soluzione
sappiamo che
ricordiamo che una reazione che ha un ΔG° =0 si trova in equilibrio essendo in questo caso
ΣΔG°prodotti = ΣΔG°reagenti
e quindi ΔG° è direttamente in relazione alla costante di equilibrio K della reazione infatti
ΔG°= -RT lnK
quindi all’equilibrio essendo ΔG° = 0
allora 0 = – RTlnK ed essendo R e T diversi da 0 è chiaro che lnK =0 e perchè lnK sia uguale a zero deve necessariamente essere
K=1
quindi la risposta corretta è C
10. La costante cinetica per una data reazione del primo ordine è 5 ·10–3 s–1 a 10 °C, mentre il suo valore è 7,2 ·10–3 s–1 a 20 °C. L’energia di attivazione della reazione vale:
A) 25 kJ mol–1 B) 250 kJ mol–1 C) 2500 J mol–1 D) 250 J mol–1
soluzione
L’equazione di Arrhenius mette in relazione la costante cinetica e la variazione di temperatura. la sua forma matematica è
dove:
k = coefficiente di velocità;
T = temperatura assoluta (in gradi K);
R = costante dei gas (8,314J);
A = fattore di frequenza;
E = energia di attivazione
questa equazione si può riscrivere in forma logaritmica
per una stessa reazione a due temperature differenti si può scrivere
ln K1 – ln K2= – Ea/RT1 + Ea/RT2 = Ea/R ( 1/T2 – 1 /T1)
ovvero : ln K1/K2= Ea/R ( 1 /T2 – 1/T1)
che può essere espressa anche come:
ln K2/K1= Ea/R( 1/T1 – 1/T2)
da questa equazione è possibile calcolare E note le costanti di velocità alle temperature T1 e T2.
Ea= 8,314 x ln K2/K1 / 1/t1-1/T2
Nel caso specifico
T1=273 +10 =283K
T2 = 273+20 =293 K
K1= 5 x 10-³ s-1
K2= 7,2 x 10-³ s-1
R=8,314 J
Ea= 8,314 x ln K2/K1 /( 1/t1-1/T2)
Ea =8,314 x ln 7/5 / (3,5 34 x 10-3 – 3,413 x 10-3)
Ea= 8,314 x ln1,44 / 0,000121
Ea= 8,314 x 0,365 / 0,000121
Ea= 3,03 / 0,000121 = 25041 J = 25,041 KJ
risposta corretta A
11. Si consideri la reazione in cui l’ozono spontaneamente forma ossigeno molecolare. Indicando con x la velocità con cui si consuma l’ozono, quale sarà la velocità con cui si forma l’ossigeno molecolare?
A) 1/2 x B) x C) 2 x D) 3/2 x
soluzione
la reazione di formazione dell’ossigeno dall’Ozono è:
2O3 → 3O2
dalla reazione è evidente che su 2 molecole di ozono si formano 3 molecole di ossigeno quindi la velocità di formazione dell’ossigeno è 3/2 X.
12. Un reagente A si decompone con una legge cinetica del primo ordine, la cui costante è 0,02 s–1. Il tempo necessario affinché la concentrazione di A si riduca ad un centesimo di quella iniziale è:
A) i dati non sono sufficienti
B) 3 minuti e 50 secondi
C) 2 minuti e 40 secondi
D) 120 secondi
soluzione
per una reazione A→ B la rela zione cinetica è
V= k[A]
V = -d[A]/ dt d[A]/ dt = – k[A] [A] =[A°] e-kt
k= 0,02 s-1 [A°] = 1 [A] =1/100 = 10-2= 0,01
3 UO2 (s) + O2 (g)→ U3O8 (s) ΔH° = -318 kJ mol–1
3 U (s) + 4 O2 (g) ® U3O8 (s) ΔH° = -3571 kJ mol–1A) -1084 kJ mol–1
B) -3250 kJ mol–1
C) +3250 kJ mol–1
D) i dati forniti non sono sufficientisoluzionesappiamo che
14. Si consideri la reazione:
2 SO2 (g) + O2 (g) → 2 SO3 (g) per la quale il ΔH° è negativo.
Come è possibile spostare l’equilibrio verso la formazione dei prodotti?
A) non si può influire sull’equilibrio termodinamico di una reazione
B) aggiungendo SO3
C) diminuendo la temperatura e/o aumentando la pressione
D) aggiungendo un catalizzatore
soluzione
Una reazione in cui il ΔH è negativo è una reazione esotermica in cui si sviluppa calore
Q = – ΔU – p × ΔV = –Δ ( U + pV )
H = U + pV,
Q = – ΔH
In una reazione chimica del tipo A+B<=> C+D + calore
dobbiamo considerare il calore come se si trattasse di un altro composto chimico, quindi se interveniamo dall’esterno aumentando il calore( la temperatura del sistema) la reazione avviene da destra a sinistra. Viceversa se diminuiamo il calore ( la temperatura) la reazione favorita è verso la formazione dei prodotti in obbedienza al principio di Le Chatelier.
Ciò comporta che per favorire la formazione di prodotto nella reazione data sopra, è necessario diminuire la temperatura del sistema oppure aumentare la pressione perchè questa fa aumentare il numero di urti tra le molecole reagenti favorendo quindi la reazione.
Da quanto esposto, la risposta corretta al quesito è C
15. Si consideri la dissociazione dello ioduro di idrogeno
2 HI (g) → H2 (g) + I2 (g)
La reazione ha una cinetica del secondo ordine e, a 560 K, la costante cinetica vale 3,517 ·10–7 dm3 mol–1 s–1. In un recipiente di 3,0 dm3 sono state introdotte 2,0 mol di HI. In quanto tempo si riducono a 0,5 moli?
A) 5 minuti B) 5 ore C) 5 giorni D) 5 mesi
soluzione
sappiamo che per una reazione del secondo ordine del tipo A²→ B la cinetica è :
d[A]/dt=−k[A]² d[A]/ [A]² = -kdt ed integrando tra [A]° e [a]t si ottiene
1/[A]t = (1/[A°] ) + kt
la concentrazione iniziale di A è[A°]= 2 moli/3litri = 0,667 M
la concentrazione al tempo t deve essere 0,5 moli /3 litri = 0,167 M
5,99- 1,499= 3,517 x 10-7 t
4,491 /3,517 x 10 -7 = t
t= 1,28020228 x 107 sec = 4,9 mesi
16. Per un sistema che subisce una transizione di fase reversibile la variazione di entropia è uguale a:
A) la variazione di entalpia
B) zero
C) la variazione di energia di Gibbs
D) la variazione di entalpia divisa per la temperatura
soluzione
Nei processi reversibili (cioè quei processi in cui due stati di un sistema differiscono di un infinitesimo) in un passaggio di stato, si ha una variazione di entropia che rappresenta la misura del disordine di una sostanza, aumenta nella transizione da uno stato solido ad una struttura liquida che è molto più disorganizzata rispetto al solido.
Le transizioni di fase avvengono in condizioni di pressione e temperatura costante, e la variazione di entropia è data da:
ΔS = ∫dqrev/T = 1/T ∫ dqrev = dqrev/T
Poiché il calore a pressione costante corrisponde alla variazione di entalpia si ha:
dqrev= qp = ΔH
la variazione di entropia in un passaggio di stato può essere quindi espressa dall’equazione:
ΔS = ΔH/T
mentre se non si ha passaggio di stato il ΔS del sistema in caso di riscaldamento o raffreddamento è
ΔS = n Cp ln T2/T1 (Cp è il calore specifico a pressione costante)
pertanto la risposta corretta al quesito è D
17. La temperatura è:
A) una misura del calore posseduto da un corpo
B) una misura del lavoro che un corpo può svolgere producendo calore
C) un indice il cui valore numerico accomuna tutti i corpi in equilibrio termico tra loro
D) una misura dell’entalpia posseduta da un corpo
soluzione
la temperatura è la misura del flusso di calore che si trasferisce da un corpo più caldo ad uno meno caldo sino a raggiungere uno stato di equilibrio termico.
da questa definizione si evince che la risposta corretta al quesito e C
18. Un recipiente contiene 21,0 g di una miscela gassosa alla pressione di 500 kPa e alla temperatura di 298 K. La miscela, costituita solo da idrogeno ed azoto, è stata ottenuta dalla decomposizione completa dell’ammoniaca. Il volume del recipiente è:
A) 1,2 m3 B) 120 dm3 C) 12 m3 D) 12 dm3
soluzione
la decomposizione dell’ammoniaca è
2 NH3<=> N2 + 3H2
i grammi di N2 si ottengono dalla reazione precedente infatti se da 2 NH3 si ottiene 1 di N2 allora da 21 g se ne ottengono X
2 x 17 : 28 = 21 :X X= grammi di azoto = 17,29 g di N2
2 x 17: 6 = 21 : Y Y= grammi di idrogeno = 3,7 gr di H
sappiamo anche che
P V= nRT = (nA + nB)RT pertanto Vtot = (moli di azoto+ moli di H2) x R x T
moli di N2= 17,29/28 = 0,617 moli
moli di H2 = 3,7 /2,016= 1,835 moli
moli totali = 1,835 + 0,617 = 2,45
quindi il volume è V= 2,45 x 298 x 8,314/500 = 12,1 litri = 12,1dm³
risposta corretta D
19. A tutte le temperature superiori alla temperatura critica
A) il volume di un gas è direttamente proporzionale alla pressione
B) la pressione rimane costante ed uguale alla pressione critica
C) i gas si comportano come gas ideali
D) non è possibile liquefare un gas per sola compressione
soluzione
Nelle trasformazioni di fase di una sostanza, si definisce Critica la Temperatura al di sopra della quale la sostanza non può esistere allo stato liquido nemmeno se viene compressa. I fluidi in genere rispondono all’equazione di Van deer Waals cioè
dove a rappresenta una costante caratteristica di ogni gas in funzione delle attrazioni tra le molecole che quindi aggiunge pressione al gas e b è il covolume cioè una parte di volume tipico delle molecole che non può essere compresso essendo parte del volume molecolare e che deve essere inserito nei calcoli.
Se si traccia per il fluido il diagramma di fase, come per esempio quello dell’acqua che quì mostriamo,

le curve corrispondenti alle temperature costanti sono decrescenti per valori superiori a una data Tc, e dalla Tc in su la sostanza esiste solo sotto forma di gas, a qualunque valore della pressione, e pertanto la temperatura detta è quella critica.
Si ricava che:
- da quanto esposto, si evince che la risposta corretta è D
20. Un grammo di carbone brucia fornendo circa 30 kJ. Quanti grammi di carbone sono necessari per far evaporare completamente 1 kg di acqua inizialmente a 25 °C? La capacità termica specifica dell’acqua è 4,184 J K–1 g–1 mentre ΔH°eb = 2,317 kJ g–1.
A) 88 g
B) 120 g
C) 230 g
D) 310 g
soluzione
sappiamo che
Q= m c ΔT dove m è la quantità molale c è il calore specifico e ΔT la differenza di temperatura.
Per portare 1 Kg di acqua da 25° a 100° occorrono pertanto Q = 1 x (100-25) x 4,184 =313,8 J
313,8 J sono necessari per aumentare la temperatura da 25° a 100°, tuttavia, raggiunti i 100°, si ha una transizione di fase in quanto l’acqua evapora e per bollire è necessario fornire ulteriore calore che corrisponde al ΔHeb cioè 2317J.
Ne consegue che la quantità di calore necessaria per far evaporare 1 Kg di acqua che si trova inizialmente a 25° è :
Q= 2317 + 313,8 J = 2630,8
quindi se 1 g di Carbone produce 30 J allora X grammi ne produrranno 2630,8 da cui
1:30= X:2630
X= 87,66 grammi di C che devono bruciare per l’evaporazione dell’acqua
Risposta corretta A
21. Il tempo di dimezzamento per la reazione di decadimento del radio è 1590 anni. Quanti anni sono necessari perchè il contenuto di radio presente in un minerale diventi il 20% del suo valore iniziale?
A) 3690 anni B) 2180 anni C) 2420 anni D) 3180 anni
22. Il composto R si converte in tre prodotti (P1, P2 e P3) attraverso tre reazioni che avvengono in parallelo: R fi P1 R fi P2 R fi P3 Le tre reazioni sono del primo ordine e hanno costante cinetica k1, k2 e k3, rispettivamente. La concentrazione di R, quindi, varia nel tempo secondo la relazione:
A) [R] = [R]0 – kt dove k = k1 · k2 · k3
B) [R] = [R]0 e–kt dove k = k1 · k2 · k3
C) [R] = [R]0 e–kt dove k = k1 + k2 + k3
D) [R] = (1/[R]0 + kt) –1 dove k = k1 + k2 + k3
soluzione
quando una stessa sostanza reagisce per formare prodotti diversi con più reazioni, si hanno le cosiddette reazioni complesse o parallele. Per esempio per una reazione
A→ B che avviene con una costante di velocità k1
A→ C che avviene con una costante di velocità k2
la velocità globale della reazione è V= -d[A]/dt= k1[A] + k2[A] = (k1+k2) [A]
al tempo t = 0 [A] = a0 [B] = 0 [C] = 0
quando t = t a0 = [A] + [B] + [C]
-d[A]/dt = d[B]dt + d[C]/dt = k1[A]+k2[A] = (k1+k2)[A]
[A] = a0 x e -(k1+k2 ) t
[B]+[C] = a0 – [A] = a0 [1- e -(k1+k2 ) t]
[B] =a0 ( k1/k1+k2) x [1- e -(k1+k2 ) t]
[C] = a0 (k2/k1+k2) x [1- e -(k1+k2 ) t]
si forma il prodotto della reazione più veloce.
Da quanto esposto si evince che la risposta corretta è C
23. Una soluzione ottenuta introducendo solfato di sodio in 180 cm3 di soluzione ha una pressione osmotica pari a 90 kPa alla temperatura di 298 .Quanti grammi di sale sono stati utilizzati?
A) 0,31 g B) 0,93 g C) 1,21 g D) 0,62 g
soluzione
La pressione osmotica è una proprietà colligativa delle soluzioni che dipendono cioè dalla quantità ma non dal tipo di sostanza. Quando due soluzioni a concentrazioni diverse sono separate da una membrana semipermeabile(cioè una membrana che lascia passare il solo solvente e non il soluto) si osserva che il solvente attraversa la membrana dalla soluzione meno concentrata verso quella più concentrata al fine di raggiungere un equilibrio.La pressione da applicare al fine di evitare il passaggio spontaneo del solvente si definisce Pressione Osmotica.
Per i non elettroliti si ha l’equazione identica all’equazione generale di stato dei gas dove P=π = pressione osmotica
π V = nRT
per gli elettroliti che si dissociano in ioni
π V = i x nRT
dove i rappresenta il numero di ioni che si formano dalla dissociazione dell’elettrolita.
Nel caso specifico abbiamo Na2SO4 cioè una sostanza che forma 3 ioni e quindi i = 3
le moli di sostanza sono grammi/Peso molecolare e π = 90kPa
quindi 90 x 0,180 = 3 x (grammi / 142) 8,314 x 298
2300,4 / 3 x 2477,6 = 0,3095 g = 0,31 g
soluzione corretta A
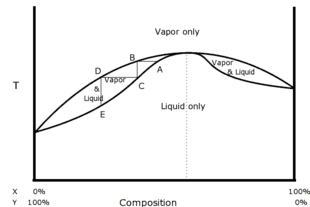
24. Le temperature di ebollizione di alcol metilico e acetone sono 64,7 °C e 56,5 °C, rispettivamente. Le miscele liquide di questi due composti, che hanno deviazioni positive dalla legge di Raoult, formano un azeotropo. La temperatura di ebollizione della miscela azeotropica è: A) 71 °C B) 58 °C C) 56 °C D) 62 °C
soluzione
La maggior parte delle miscele ha un comportamento che si discosta dall’idealità (che generalmente è osservata dai liquidi puri) e quindi la loro tensione di vapore non segue la legge di Raoult che mette in relazione la Pressione totale della miscela soluto-solvente con la pressione parziale di ogni componente e la sua frazione molare
Pparz = Ptot x moli di soluto/ moli soluto + moli solvente
Quando le molecole dei liquidi che compongono la miscela si attraggono o si respingono tra loro, a causa di legami intermolecolari, allora la miscela si discosta dalla legge di Raoult.La deviazione da questa legge comporta che le miscele abbiano un comportamento anomalo nel caso vengano sottoposte a distillazione .
La distillazione è una tecnica utilizzata per separare due o più componenti di una miscela che sfrutta la differenza delle loro tensioni di vapore e quindi delle temperature di ebollizione.
In una miscela di due liquidi , secondo la Legge di Raoult, le pressioni parziali sono proporzionali alle frazioni molari e se le tensioni di vapore di ciascuno dei due componenti e della miscela globale vengono rappresentate in un diagramma bidimensionale, presentano
l’andamento mostrato in figura ed è in relazione ad una ben precisa temperatura.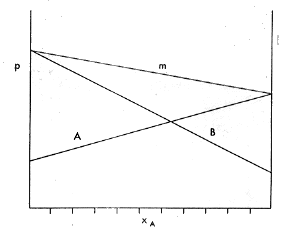
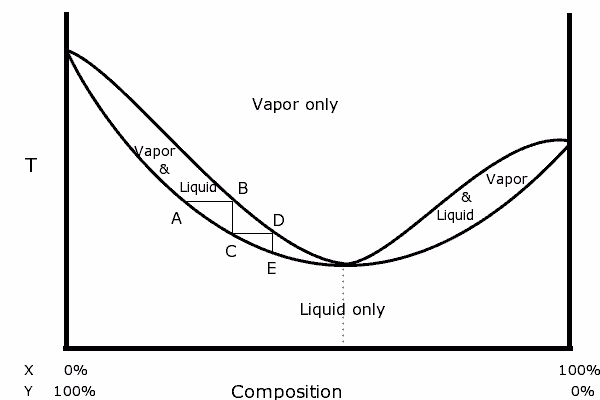
è possibile costruire anche un diagramma bidimensionale, a pressione costante, in cui possono essere evidenziate le temperature di ebollizione della diverse possibili composizioni delle miscele di due liquidi. La curva risultante è detta curva di ebollizione.

Non sempre però la curva mostra un comportamento ideale, in quanto sono possibili deviazioni dalla legge di Raoult e le curve di ebollizione (tempreatura-concentrazione) sono di due tipi
26. La reazione di carbossilazione di Kolbe per preparare l’acido salicilico, precursore dell’aspirina, è un esempio di Sostituzione Elettrofila Aromatica. La reazione procede con regioselettività orto piuttosto che para. Scegliere l’affermazione più adeguata per spiegare questo fenomeno:
A) la CO2 reagisce con lo ione fenossido per formare un estere intermedio instabile che subito si trasforma nell’acido salicilico
B) la reazione prevede la formazione iniziale dell’acido p-idrossibenzoico, che successivamente isomerizza ad acido salicilico
C) l’attacco della CO2 alla posizione para, particolarmente ricca di elettroni, è impedita da una forte repulsione elettrostatica
D) lo ione sodio esercita un effetto di chelazione della CO2 che la pone in prossimità della posizione orto
soluzione
la reazione di Kolbe-Smith procede con il meccanismo seguente:
come si vede dalla reazione scritta sopra, è lo ione sodio che esercita un effetto chelante sulla CO2 e pone quest’ultima in posizione orto.
risposta corretta D
27. Gli eteri corona sono polieteri ciclici, derivati dal glicole etilenico, e hanno struttura generale (-OCH2CH2O-)n. Sono ottimi catalizzatori nelle reazioni di sostituzione nucleofila SN2.
12 corona 4
Individuare l’affermazione in grado di spiegarne il perché:
A) la loro azione catalitica è dovuta ad un aumento di viscosità della soluzione
B) la loro azione catalitica si esplica attivando il substrato della reazione SN2
C) la loro azione di complessazione del nucleofilo lo attiva aumentando la velocità di reazione
D) la loro azione di sequestro del catione metallico aumenta la forza del corrispondente nucleofilo anionico
soluzione
Un etere corona è una molecola organica contenente idrogeno, carbonio e ossigeno: nella struttura ciclica della molecola,ogni atomo di ossigeno è legato a due atomi di carbonio e disposti ad anello. Gli eteri corona sono degli oligomeri (un oligomero è un numero finito e piccolo di unità monomeriche) dell’ossido di etilene che presentano l’unità ripetitiva –CH2-CH2-O-.
Nella nomenclatura degli eteri corona il primo numero si riferisce al numero di atomi presenti nella struttura ciclica e il secondo numero si riferisce al numero di atomi di ossigeno presenti. Possiedono una cavità interna nella molecola che è molto polare per la presenza dei doppietti elettronici solitari sugli atomi di ossigeno e possono solvatare i metalli alcalini. Poiché la parte esterna degli eteri corona è apolare, i complessi con i metalli alcalini possono sciogliersi in solventi apolari. Il composto 12 corona 4 è un ottimo complessante del litio.
Poichè gli eteri corona sono in grado di sequestrare uno ione metallico, nelle reazioni SN2 favoriscono l’azione del restante nucleofilo che attacca più facilmente la zona positiva. Il Crown Etere è quindi un catalizzatore per trasferimento di fase ovvero un catalizzatore che accelera la migrazione di reagenti in un sistema eterogeneo (costituito da due fasi ) da una fase ad un’altra dove può avvenire la reazione e l’esempio tipico è una reazione che coinvolge il sodio in un solvente apolare pur essendo il sodio insolubile nei solventi polari.
da quanto sopra la risposta corretta è D
28. Identificare il rapporto stereochimico nelle seguenti tre coppie di composti:
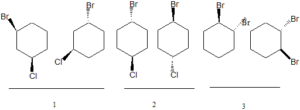
A) 1: enantiomeri; 2: diastereoisomeri; 3: molecole uguali
B) 1: diastereoisomeri; 2: molecole uguali; 3: enantiomeri
C) 1: molecole uguali; 2: enantiomeri; 3: diastereoisomeri
D) 1: diastereoisomeri; 2: enantiomeri; 3: enantiomeri
soluzione
Enantiomeri sono due molecole che sono immagini speculari l’una dell’altra e non sono quindi sovrapponibili. Sono anche chiamati isomeri ottici in quanto fanno deviare un raggio di luce polarizzata a destra o sinistra in uno strumento chiamato Polarimetro.
Gli enantiomeri sono molecole che non posseggono né piani di simmetria né centri di inversione né assi Sn superiori ed in esse è presente un centro chirale cioè un atomo di carbonio legato a quattro gruppi funzionali diversi come nella figura che rappresenta il treosio CH3CHOHCH2OH.

Tra le molecole mostrate nel quesito, si vede che le uniche ad avere un C chirale sono le molecole contrassegnate col numero 3 .
Diastereoisomeri sono due isomeri che non sono l’uno l’immagine speculare dell’altro. Essi possiedono identica formula molecolare ed uguali legami tra atomi ma hanno un orientamento nello spazio diverso, pur non essendo immagini speculari. Tra le coppie di molecole che ci mostra il quesito, la coppia di diastereoisomeri è la numero 1 in cui gli atomi di Br e Cl si trovano in posizioni diverse dell’anello ed anche si trovano sopra il piano dell’anello nella prima e sopra e sotto il piano dell’anello nella seconda.
Le molecole contrassegnate col numero 2 invece rappresentano la stessa molecola e la sola differenza è la posizione cis trans dei due atomi.
La risposta corretta è B
29. Nella classe degli idrocarburi alifatici gli alchini terminali sono caratterizzati da un’acidità relativamente elevata. Ad esempio, rispetto all’etano (pKa = 50) e all’etilene (pKa = 44) l’acetilene è notevolmente più acido (pKa = 25). Indicare la spiegazione più corretta:
A) la base coniugata dell’acetilene è più stabile di quella dell’etano e dell’etilene a causa dell’ibridazione del carbonio
B) l’acetilene ha una massa molecolare più bassa di etano ed etilene
C) la base coniugata dell’acetilene è meno stabile di quella dell’etano e dell’etilene a causa dell’ibridazione del carbonio
D) la base coniugata dell’acetilene è stabilizzata dalla risonanza
soluzione
se l’idrogeno dell’acetilene è notevolmente più acido dell’etano e dell’etilene evidentemente la base coniugata dell’etilene è notevolmente più stabile delle altre basi coniugate.
Nell’etilene si ha una ibridizzazione SP2 in cui i due atomi di C formano 3 legami ibridi che giacciono sullo stesso piano ed un orbitale non ibrido Pz che forma il doppio legame.
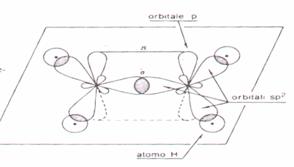
quando l’etilene perde un H da uno degli atomi di C l’ ibridizzazione di questo atomo cambia e diviene di tipo SP3 ed il doppio legame non esiste più, destabilizzando, quindi, la base coniugata.
Nell’acetilene invece i due atomi di C sono ibridi SP e formano un triplo legame
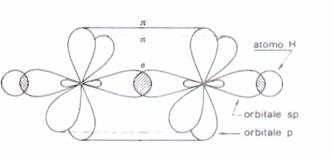
quando si stacca l’idrogeno come H+, la carica negativa che rimane rimane nell’ orbitale ibrido e l’ibridizzazione non cambia.Ciò comporta la maggiore stabilità di questa base coniugata rispetto alle altre.
ne consegue che la risposta esatta è A
30. La ipso-sostituzione è un caso speciale di sostituzione elettrofila aromatica, nella quale il gruppo uscente non è lo ione H+. Tenendo conto del meccanismo di reazione, prevedere quale dei seguenti substrati sarà più propenso a dare la ipso-sostituzione:
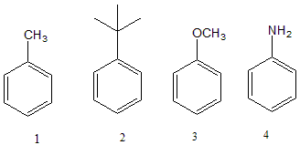
A) 1 B) 2 C) 3 D) 4
soluzione
nelle reazioni di sostituzione elettrofila aromatica con sostituenti nell’anello, sappiamo che il CH3- è un attivante ed orienta in Orto- Para mentre il gruppo CH3O oriente in orto meta ed il gruppo NH2 orienta in orto para e nelle reazioni di sostituzione elettrofila il gruppo uscente è l’idrogeno.Ad es.nel caso della nitrazione dell’1-4 dimtil benzene il meccanismo è :
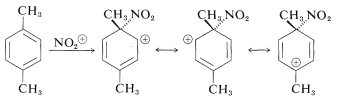
poichè CH3 stabilizza il catione intermedio . L’ attacco al carbonio sostituito cioè che è legato al CH3 (ipso) con eliminazione del gruppo CH3 non avviene
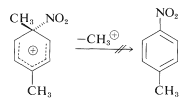 NO !
NO !
perchè il gruppo Nitro che attacca il C ipso, subito cambia posizione e va sul carbonio vicino che può quindi eliminare un H
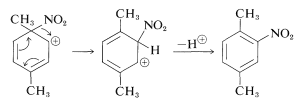 Si !
Si !
In linea generale gli attacchi al benzene sostituito sono quasi sempre complicati dagli attacchi ipso infatti se consideriamo la reazione
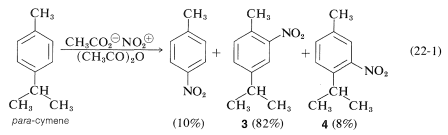
si vede che il 10% è il prodotto è la nitrazione con sostituzione del gruppo isopropilico che al contrario del CH3 visto sopra, viene eliminato come propene e viene sostituito dal gruppo NO2.
Dalla definizione di sostituzione elettrofila ipso data sopra possiamo concludere che tra i composti proposti dal quesito, solo il gruppo isopropilico può essere sostituito con sostituzione ipso ma la resa di reazione non è mai elevata.
Risposta corretta B
31. La rimozione di un idrogeno sul carbonio sp3 in alfa ad un gruppo carbonilico genera un anione stabilizzato per risonanza detto ione enolato. Generalmente, per formare l’enolato con resa del 100% si usano basi forti e stericamente ingombrate, come la litio diisopropilammide (LDA). Qual è il motivo per dover usare una base stericamente impedita?

A) evitare che venga coordinata dall’ossigeno carbonilico
B) impedire che possa attaccare il carbonio carbonilico e così agisca solo nei confronti dell’idrogeno
C) evitare eventuali reazioni di ossidazione dell’azoto basico
D) impedire l’effetto solvatante che ne ridurrebbe la basicità
soluzione
Il valore di pKa del litio diisopropilammide permette la deprotonazione di alcoli,aldeidi,chetoni,acidi carbossilici che posseggono un atomo di H nella posizione alfa, permettendo così la formazione di ioni enolato.I composti di litio e magnesio organici sono basi talmente forti che possono strappare H+ ad ogni altro gruppo funzionale.
L’acidità del protone legato al carbonio in α compete con la natura elettrofila del carbonio carbonilico, analogamente a quanto accade con gli acidi carbossilici e le ammidi primarie e secondarie.
L’LDA è stericamente ingombrante e protegge il Carbonio carbonilico dall’attacco favorendo invece l’attacco all’idrogeno in alfa. Questo avviene quando il chetone è simmetrico come in questo caso ma se il chetone è asimmetrico
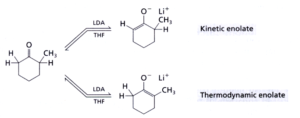
Si possono formare due enolati: il primo è quello che si forma più velocemente e viene chiamato prodotto cinetico (enolato cinetico)
Il secondo è quello più stabile e viene chiamato prodotto termodinamico (alchene tetrasostituito). E’ quello che si forma principalmente se il sistema viene portato all’equilibrio.
Con LDA che è una base forte e ingombrante ed a bassa temperatura si ha il controllo cinetico
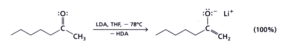
Con una base meno forte, poco ingombrante e ad alta temperatura si ha invece
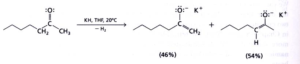
da quanto sopra, la risposta corretta è B
32. A differenza degli acetali aciclici, quelli ciclici a 5 e 6 termini, generati per reazione di aldeidi e chetoni con 1,2 e 1,3-dioli, si formano abbastanza facilmente.

Quale tra le seguenti affermazioni può spiegare questo andamento?
A) 1,2 e 1,3-dioli formano legami idrogeno intramolecolari che ne aumentano la reattività nucleofila
B) gli acetali ciclici hanno maggiore tendenza di quelli aciclici a formare oligomeri non covalenti, con conseguente aumento della cinetica di formazione
C) il secondo stadio per la formazione di un acetale ciclico è intramolecolare, ed è favorito dalla vicinanza dei due gruppi funzionali che devono reagire
D) la maggiore volatilità degli acetali ciclici sposta l’equilibrio verso destra
soluzione
per quanto riguarda la prima delle reazioni, il meccanismo è il seguente:
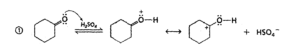
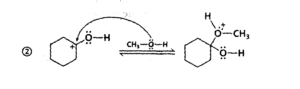
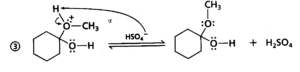
e per quanto riguarda la seconda reazione :
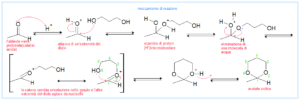
come si vede la seconda parte della reazione procede con la formazione di legami intramolecolari tra due gruppi vicini, quindi la risposta corretta è C
33. Nella reazione di acilazione di Friedel-Crafts il benzene viene fatto reagire con un alogenuro acilico in presenza di un acido di Lewis, come AlCl3. Qual è la sua funzione?
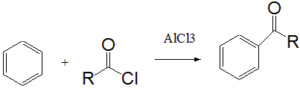
A) coordinarsi al benzene per renderlo più reattivo verso l’alogenuro acilico
B) promuovere la scissione del legame carboniocloro dell’alogenuro acilico per generare l’elettrofilo della reazione con il benzene
C) promuovere la scissione del legame carboniocloro dell’alogenuro acilico per generare il nucleofilo della reazione con il benzene
D) proteggere il chetone aromatico prodotto durante reazione dall’HCl formato
soluzione
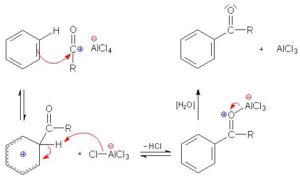
Come si vede dal meccanismo descritto, AlCl3 reagisce col cloruro acilico staccando il cloro e formando il complesso AlCl4– dando origine all’elettrofilo R-C+=O che attacca il doppio legame del benzene e nel contempo AlCl4- stacca un idrogeno dal benzene per riformare AlCl3 ed HCl. A sua volta AlCl3 riformatosi si lega all’ossigeno del CO e si distacca successivamente per azione dell’H2O.
Ciò significa che la riposta corretta è B
34. L’acido stearolico, C18H32O2, per idrogenazione catalitica produce acido stearico mentre per scissione ossidativa produce acido nonanoico e nonandioico. Qual è la struttura dell’acido stearolico?

A) 1 B) 2 C) 3 D) 4
soluzione
l’acido nonandioico o acido azelaico C9H16O4 ha la seguente struttura:
![]()
l’acido nonanoico detto anche acido pelargonico(dalla pianta pelargonium che lo contiene) è un acido con un numero dispari di atomi di Carbonio

sapendo inoltre che l’ossidazione di un legame multiplo doppio o triplo produce alle due estremità un gruppo COOH allora possiamo dire che
l’ossidazione dl composto numero 1 porterebbe a un acido dioico con 8 atomi di carbonio ed un acido con 10 atomi quindi non può essere l’acido stearolico.
Il composto numero 2 darebbe per ossidazione 2 acidi dioici e quindi è da escludere.
Il composto numero 3 per ossidazione porta ad un acido dioico con 8 atomi ed un acido con 10 atomi
Il composto numero 4 invece per idrogenazione forma l’acido stearico e l’ossidazione del triplo legame forma i due acidi la cui struttura è data sopra.
la risposta corretta è D
35. Il trealosio è un disaccaride non riducente che per idrolisi acida fornisce 2 equivalenti di D-glucosio. La metilazione seguita da idrolisi produce 2 equivalenti di 2,3,4,6-tetra-O-metil-glucosio. Quali delle seguenti strutture sono possibili per il trealosio?
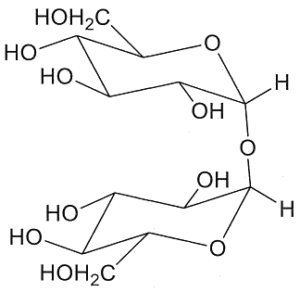

1 2

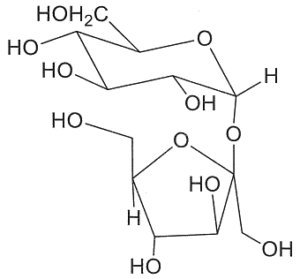
3 4
A) 1 e 3 B) 1 e 4 C) 1 e 2 D) 2 e 3
soluzione
la coppia 1-4 è da escludere perché la molecola 4 non forma 2 quivalenti di 2,3,4,6 tetra-o-metilglucosio ma uno soltanto.
La molecola 3 non forma 2 equivalenti di 2,3,4,6 tetra-o-metilglucosio
quindi la coppia che forma 2 equivalenti di glucosio e 2 equivalenti di 2,3,4,6 tetra-o-metilglucosio è la coppia 1-2
risposta corretta C
36. Individuare il più stabile tra i seguenti conformeri del trans e del cis 1-cloro-2-metilcicloesano
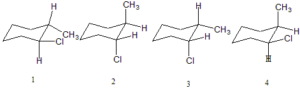
A) 1 B) 2 C) 3 D) 4
soluzione
Nella forma a sedia del cicloesano, che sappiamo essere la forma più stabile, 6 dei 12 atomi di idrogeno sono in posizione assiale, cioè i legami C-H sono tra loro paralleli e perpendicolari al piano medio della molecola, gli altri 6 sono in posizione equatoriale, che cioè si protendono verso l’esterno, inclinati alternativamente al di sopra e al di sotto del piano medio della molecola.
Quando al posto degli idrogeni vi sono dei gruppi sostituenti, come nel caso in esame, la forma a sedia più stabile è quella che lascia i sostituenti più ingombranti (in tal caso CH3 e Cl ) in posizione equatoriale; in questo modo viene minimizzato l’ingombro sterico della molecola. Si vede che la molecola che possiede il CH3 in posizione equatoriale è la numero 1 ed è evidentemente la più stabile.
risposta corretta B
37. La reazione di cicloaddizione di Diels-Alder coinvolge due sistemi insaturi, un diene e un dienofilo, per dare vita a un anello a sei termini tramite la formazione di due nuovi legami σ a spese di due legami π. E’ un esempio di addizione sin, con la stereochimica del dienofilo mantenuta nel prodotto di reazione. Prevedere quale sarà il prodotto della seguente reazione
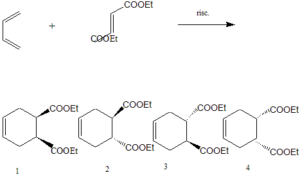
A) una miscela di composti 1 e 4
B) una miscela di composti 2 e 3
C) solo il composto 3
D) una miscela di composti 2 e 3 come prodotti maggioritari ed 1 e 4 come prodotti minoritari
soluzione
poichè la stereochimica viene mantenuta, essendo il reagente con i gruppi COOEt in posizione trans, allora i composti possibili sono il numero 2 ed il numero 3 essendo invece i composti 1 e 4 con stereoisomeria CIS.
risposta corretta B
38. Quale tra i seguenti metodi può essere utilizzato per risolvere una miscela racemica?
A) una separazione cromatografica utilizzando una fase stazionaria chirale
B) una cristallizzazione frazionata
C) una distillazione in corrente di vapore
D) un esperimento polarimetrico
soluzione
39. La saponificazione degli esteri è una reazione di idrolisi promossa dalle basi che va a completezza. Il meccanismo della reazione è descritto in tre stadi. Quale di questi stadi trascina la reazione a destra rendendola irreversibile?
1 
2 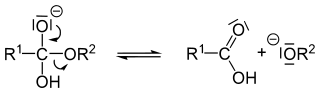
3 
A) i primi due stadi
B) lo stadio 3
C) gli stadi 2 e 3
D) lo stadio 2
soluzione
L’alcossido R2O- è una base più forte della base coniugata dell’acido carbossilico, quindi il trasferimento del protone è favorito. La reazione numero 3 è pertanto non reversibile e quindi la risposta corretta è B
40. Il comportamento degli amminoacidi in soluzione sottoposti a un campo elettrico dipende dal loro punto isoelettrico (pI) e dal pH della soluzione. Cosa succede ad una soluzione contenente lisina, glicina e acido aspartico a pH = 5,97 in un campo elettrico? (pI: glicina = 5,97; lisina = 9,74; acido aspartico = 2,77)
A) la lisina si muove verso l’anodo, l’acido aspartico verso il catodo e la glicina resta ferma
B) La glicina si muove verso l’anodo e lisina e acido aspartico restano fermi
C) La lisina si muove verso il catodo, l’acido aspartico verso l’anodo e la glicina resta ferma
D) I tre amminoacidi si muovono con velocità diverse verso il catodo
soluzione
la glicina è
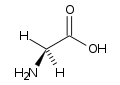
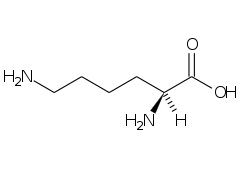
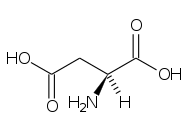
glicina lisina acido aspartico
Gli amminoacidi presenti in natura sono 20 ed hanno un gruppo amminico, NH2 legato al C ed un gruppo carbossilico. Le basicità relative dell’anione carbossilato e del gruppo amminico indicano che gli amminoacidi debbano esistere come ioni dipolari, anche detti zwitterioni, in cui il gruppo amminico è protonato mentre il carbossile esiste come ione carbossilato.

a PH molto bassi la specie esistente è la 1 in cui il carbossile è protonato così come il gruppo amminico che si carica positivamente.
a PH molto basici la specie presente è la numero 3 che presenta una crica negativa al carbossile lasciando inalterato il gruppo amminico
a PH intermedi, la specie è la numero 2 in cui l’amminoacido non ha carica netta
L’elettroforesi degli aminoacidi è una tecnica di separazione che si basa sulla diversa mobilità di ioni in un substrato sottoposto ad un campo elettrico. Gli ioni si muovono più o meno rapidamente lungo il substrato in funzione della loro carica, dimensione, forma ed ovviamente del PH che ne condiziona la carica.Il campione va sciolto in un tampone, e se l’elettroforesi viene effettuata su un supporto che generalmente è uno dei seguenti :
- Cellulosa (carta)
- Acetato di cellulosa
- Silice (gel)
- Amido (gel)
- Agarosio (gel)
- Poliacrilamide (gel)
- Sephadex (gel)
questo deve essere saturato col tampone per consentire la conduzione della corrente. Il tampone serve, inoltre, per mantenere costante lo stato di ionizzazione delle molecole da separare, la cui carica cambia con il pH, soprattutto nel caso di ioni dipolari. La velocità dì migrazione aumenta all’aumentare della carica netta del campione e la grandezza della carica dipende, generalmente, dal pH, in base al grado di dissociazione dell’aminoacido. La forza ionica del tampone influisce sulla velocità di separazione ed a bassa forza ionica , la quota di corrente trasportata dal tampone diminuisce e aumenta la quota di corrente trasportata dal campione che incrementa, così, la sua velocità dì migrazione.(essa è normalmente compresa tra 0.05 e 0.10 M.). Sia la direzione, sia la velocità di migrazione degli aminoacidi dipendono dal pH ed tamponi usati per la loro separazione hanno un pH compreso fra 1 e 11.
mettiamo in ordine i tre ammioacidi secondo una scala di PI crescente: dal più piccolo al più grande.
P.I.acido aspartico = 2,77
pI: glicina = 5,97
P.I. lisina = 9,74;
Poichè il tampone ha un pH pari al punto isoelettrico dell’amminoacido glicina ne deriva che :
– l’amminoacido con PI uguale al pH del tampone cioè la glicina rimane immobile
– l’ammonoacido con PI inferiore al pH quale l’acido aspartico si presenta carico positivamente, quindi migra verso il polo negativo
– l’ammonoacido con PI superiore al pH si presenta carico negativamente, per cui migra verso il polo positivo
41. Indicare la specie planare quadrata
A) CH2Cl2 B) XeO4 C) ICl4– D) CuCl42–
soluzione
la struttura di CH2Cl2 è tetraedrica come la struttura di XeO4 è in cui Xe è ibrido SP3 come il Carbonio ed il Cu , mentre ICl4+ ha la forma di bipiramide trigonale
42. Quali orbitali ibridi forma l’atomo centrale nello ione PF6– ?
A) sp5 B) sp3d C) sp4d D) sp3d2
soluzione
la struttura del PF6- è una stuttura a bipiramide quadrangolare :
queso tipo di struttura presuppone una ibridizzazione del fosforo SP3d2.
La struttura del fosforo è
43. Indicare l’ordine di legame dello ione O2+:
A) 2 B) 1 C) 1,5 D) 2,5
soluzione
l’ ordine di legame si calcola utilizzando la seguente formula:
ordine di legame = numero di elettroni di legame – numero di elettroni di antilegame /2 elettroni(o legami)
Consideriamo gli Orbitali molecolari dell’O2 :
vi sono 16 elettroni totali e 6 elettroni di legame negli O.M. di legame e 2 elettroni di antilegame. nella molecola di O2+ vi è un elettrone in meno rispetto ad O2 quindi rimane 1 solo elettrone antibondng.
Applicando la formula scritta sopra abbiamo :
6 – 1 / 2 = 5/2 quindi l’ordine di legame per O2+ è 2,5
risposta corretta D
44. Quale delle seguenti specie, che rappresentano eccezioni alla regola dell’ottetto, possiede l’atomo centrale con il maggior numero di elettroni intorno a sé?
A) SbF6– B) POCl3 C) XeO4 D) ICl5
soluzione
la molecola SbF6- ha struttura ottaedrica in cui l’antimonio possiede 5 elettroni esterni mentre il fluoro ne ha 7 + 1 carica negativa quindi il n. di elettroni è 5 + 7×6 +1 = 48 elettroni di cui ogni atomo di F possiede 3 doppietti ed 1 elettrone lo condivide con l’Sb.
Quindi, Sb, l’atomo centrale ha intorno 8 elettroni.
Nella molecola POCl3 il fosforo ha 5 elettroni l’ossigeno 6 ed il cloro 7 quindi il numero di elettroni è: 5+6+7×3 = 32 elettroni ed ogni atomo di cloro possiede 6 elettroni mentre 1 lo condivide col fosforo, ed inoltre vi è un doppio legame (4 elettroni) che legano il fosforo all’ossigeno.
L’atomo centrale P ha intorno 10 elettroni
Nella molecola XeO4 lo Xeno ha 8 elettroni esterni e l’ossigeno 6 ( x 4) pertanto il numero di elettroni totali è 32. Di questi 4 elettroni per ogni atomo di ossigeno formano doppi legami con lo Xe per cui
lo Xe, atomo centrale ha intorno 4 x 4 = 16 elettroni
Nella molecola ICl4 lo Iodio ha 7 elettroni ed altrettanti ne ha il Cl quindi in totale vi sono 7+35 = 42 elettroni
di questi, 5 elettroni dello Iodio formano il legame con Cl e sullo Iodio rimangono i 2 eletroni dei 7 originari
quindi l’tomo centrale che è lo iodio ha intorno 8 elettroni più i due elettroni dello stesso Iodio.
Ne consegue che l’ atomo che ha intorno più elettroni è lo Xeno in XeO4
risposta corretta C
45. L’acido fluoridrico liquido (d = 1,002 g mL–1) presenta un equilibrio di autoprotolisi simile a quello dell’acqua: 3 HF (l)↔ H2F+ (sol) + HF2– (sol) che ha costante di equilibrio KHF = 8 x 10-12. Calcolare la frazione molare di HF2– (sol) all’equilibrio.
A) 2,80 ·10–6 B) 5,65 ·10–8 C) 0,93 D) 9,33 ·10–7
soluzione
3HF ↔ H2F+ + HF2-
Ca(1-x) Ca x Ca x
dal valore di Keq si deduce che X è molto piccolo per cui il valore 1-x si può considerare uguale ad 1
essendo
Ka= 8 x 10-12 = [H2F+] + [HF2-] = X²
8 x 10-12 = X² da cui si ottiene X =√8 x 10-12 = 2,82 x 10-6 moli/l
Calcoliamo adesso il numero di moli di HF :
essendo la densità 1,002 g/ml è quindi 1002 g/L pertanto la Ca= 1002/20 = 50,1 M
Conosciamo adesso sia il numero di moli di H2F+ che di HF2- e di HF e quindi le moli totali sono 50,1 + 2,82 x 10-6 + 2,82 x 10-6
essendo però e moli di H2F- ed HF2- quantità trascurabili rispetto a 50,1 allora moli totali = 50,1
pertanto la frazione molare di HF2 + = HF2- è data da Moli di HF2- / moli totali
fraz.molare = 2,82 x 10-6 / 50,1 = 0,0565 x 10-6 = 5,65 x 10-8
46. Il paracetamolo viene preparato per reazione del p-amminofenolo con anidride acetica. Perché l’acetilazione avviene preferenzialmente sul gruppo NH2 rispetto a quello OH?
A) per ragioni di ingombro sterico
B) per la maggior elettrofilicità del gruppo amminico
C) per la maggior nucleofilicità del gruppo amminico
D) dipende dall’anidride scelta
soluzione
la reazione è la seguente:
Il gruppo -NH2 è un forte attivante dell’ anello benzenico cioè aumenta la densità elettronica del’anello ed è più nucleofilo dell’ossigeno che è anch’esso attivante, per cui l’attacco avviene prevalentemente sull’NH2. Il primo gradino della reazione è l’ attacco nucleofilo all’orbitale antibonding del CO e si spezza il legame π.
Si può notare che se l’ossigeno fornisse il doppietto al CO in realtà il composto risultante avrebbe un legame che si spezzerebbe facilmente e si avrebbe nuovamente l’anidride acetica di partenza. Pertanto l’attacco prevalente sull’azoto è dovuto alla maggiore nucleofilicità dell’azoto rispetto all’ossigeno.
Risposta corretta C
47. La basicità delle alchilammine aumenta, in fase gassosa, passando dalle ammine primarie alle terziarie, NH2R < NHR2 < NR3, a causa dell’effetto elettrondonatore dei gruppi alchilici. In soluzione acquosa, invece, le ammine terziarie risultano essere meno basiche delle ammine primarie. Indicare la spiegazione più corretta:
A) in soluzione si verifica un’inversione dell’effetto induttivo dei gruppi alchilici, che diventano elettronattrattori
B) in soluzione i tre gruppi alchilici legati all’atomo di azoto interferiscono con la solvatazione del catione trialchilammonio che, quindi, è meno stabilizzato
C) in soluzione si osserva una modifica di ibridazione dell’atomo di azoto da sp3 a sp2
D) in soluzione le ammine terziarie sono facilmente ossidabili, generando specie poco basiche
soluzione
L’azoto legato a un gruppo alchilico R (che è un gruppo elettrondonatore) assume una maggiore densità di carica che rende la molecola più basica rispetto all’ammoniaca da cui si può ritenere che derivi. Tuttavia se si dovesse considerare solo l’effetto induttivo del gruppo o dei gruppi alchilici legati all’azoto, ci dovremmo aspettare in soluzione una maggiore basicità delle ammine terziarie.
In realtà però le ammine secondarie hanno una maggiore basicità che non le primarie e le terziarie con l’ordine dio basicità seguente :
NH3 < ammine primarie ~ ammine terziarie < ammine secondarie
Bisogna quindi considerare, oltre all’effetto induttivo, altri due importanti fattori:
- Impedimento sterico
- Effetto di solvatazione degli ioni
il numero e le dimensioni dei gruppi legati all’azoto ostacolano l’azione del doppietto dell’azoto nei confronti dell’idrogeno dell’acqua e ciò comporta che le ammine terziarie pur determinando una maggior densità elettronica sull’azoto per effetto induttivo, al contempo esercitano un impedimento sterico che ne diminuisce la basicità nel senso che rende meno disponibili gli elettroni del doppietto, ecco perché le ammine secondarie sono le più basiche rispetto alle terziarien dove i tre gruppi alchilici legati all’azoto interferiscono con la solvatazione del catione trimetilammonio che, quindi, viene ad essere scarsamente stabilizzato.
Risposta corretta B
48. Il primo metodo per l’arricchimento dell’uranio prevedeva l’utilizzo della diffusione di UF6 gassoso. Utilizzando questa tecnica viene sfruttata la differenza di velocità tra gli isotopi, in particolare si riesce a separare l’isotopo 235U dal più pesante 238U. Qual è il rapporto tra la velocità del gas contenente 235U e quella del gas contenente 238U?
A) 1,004 B) 0,996 C) 1,025 D) 0,976
soluzione
Dall’uranio-238 per cattura di neutroni e decadimento radioattivo si ottiene il plutonio-239:
238U + n → 239U → 239Pu + β–
tuttavia il solo isotopo che subisce fissione nucleare a causa di neutroni lenti è l’uranio-235 che deve pertanto essere separato dal 238.
Il processo ha inizio facendo reagire l’uranio metallico con fluoro, ottenendo esafluoruro di uranio (UF6):
U + 3F2 → UF6
L’esafluoruro di uranio che è solido passa in fase gassosa molto facilmente per sublimazione. Il composto fluorurato di uranio 235, essendo più leggero (pesa 349 uma) del suo isotopo 238 ( che pesa 352 uma) ha una velocità di diffusione leggermente maggiore e la diversa velocità di diffusione è valutata dalla legge di Graham:
V1/V2 = √ M2/M1
pertanto il rapporto tra le due velocità è :
V2/V1 = √352/549 = 1,0042
risposta corretta A
49. L’effetto fotoelettrico è un fenomeno fisico che prevede l’espulsione di elettroni da una superficie, tendenzialmente metallica, in seguito a irraggiamento con onde elettromagnetiche. La spiegazione di questo fenomeno è storicamente importante dal momento che rappresenta la conferma:
A) della natura ondulatoria dell’elettrone
B) della natura quantistica dell’atomo
C) della natura corpuscolare della radiazione
D) della natura ondulatoria della radiazione
soluzione
Quando una superficie metallica viene colpita da una radiazione luminosa, se questa ha una determinata lunghezza d’onda, si verifica l’emissione di elettroni dalla superficie metallica e l’effetto si chiama effetto fotoelettrico.
Einstein diede la corretta interpretazione del fenomeno sostenendo che l’estrazione degli elettroni dal metallo fosse possibile solo ipotizzando che la luce fosse costituita da pacchetti o corpuscoli che chiamò Fotoni. La conferma dell’aspetto corpuscolare della luce venne effettuata da Compton che dimotrò che i fotoni si comportano come particelle materiali con una loro energia e quantià di moto.
risposta corretta C
50. Quale dei seguenti metalli presenta una configurazione elettronica con l’orbitale d completo?
A) Fe B) Cu C) Ni D) Co
soluzione
la struttura atomica degli elementi è:
Fe 26 elettroni [Ar]3d64s2
Co 27 elettroni [Ar]3d74s2
Ni 28 elettroni [Ar]3d84s2
Cu 29 elettroni [Ar]4s13d10
da quanto sopra si evince che l’atomo con tutti gli orbitali d occupati è il rame.
risposta corretta B
51. Un’onda elettromagnetica con lunghezza d’onda di 242 nm è in grado di dissociare l’ossigeno molecolare rompendo il legame covalente. Calcolare l’energia di dissociazione molare di O2 (h = 6,63 ·10–34 J s; c = 3 ·108 m s–1)
A) 495 kJ mol–1
B) 8 ·10–19 J
C) 8 ·10–19 J mol–1
D) 257 kJ mol–1
soluzione
L’equazione di Einstein mette in relazione l’energia di un fotone con la sua lunghezza d’onda :
E= h ν dove ν = frequenza della radiazione cioè ν = C/ λ dove λ è la lunghezza d’onda della radiazione.
Pertanto E = 6,62 x 10-34 x 3 x 108 / 242 = 19,9 x 10-26 / 242 x 10-9 = 0,0822 x 10 – 17 = 8,22 x 10-19 J
poichè in 1 mole vi sono 6,02 x 1023 molecole, si ha un’energia di dissociazione pari a
E = 8,22 x 10-19 x 6,02 x 1023 = 495x 103 J= 495 KJ /mole
risposta corretta A
52. Quante moli di Ca(OH)2 bisogna aggiungere a 250,0 mL di una soluzione acquosa di HCl 0,010 M per ottenere una soluzione a pH = 3, se il volume della soluzione dopo l’aggiunta dell’idrossido non cambia?
A) 1,13 mmol B) 2,25 mmol C) 0,23 mmol D) 4,50 mmol
soluzione
in soluzione abbiamo Volume x concentrazione = equivalenti (nel caso di HCl moli)
250ml x 0,01M = 2,5 meq di acido HCl iniziali
la soluzione risultante deve essere 10-3 M poichè il PH deve essere PH=3 quindi [H+] = 0,001 M e siccome il volume non cambia dopo aggiunta i meq corrispondenti di acido che rimangono devono essere
250 x 0,001 = 0,25 meq
quindi Ca(OH)2 deve neutralizzare solo 2,5 – 0,25 = 2,25 meq di acido
poichè dalla reazione Ca(OH)2 + 2 HCl → CaCl2 + 2H2O si evince che
1 meq di Ca(OH)2 neutralizza 2 meq di acido
si deduce che per neutralizzare 2,25 meq di acido occorrono
1:2:= X :2,25 X = 1,125 = 1,13 meq di Ca(OH)2 necessari perche il PH sia uguale a 3
risposta corretta A
53. Quale delle seguenti sostanze ha il punto di ebollizione più elevato?
A) F2 B) Cl2 C) Br2 D) I2
soluzione
Il punto di ebollizione diminuisce lungo i periodi da sinistra verso destra, infatti a sinistra troviamo i metalli e a destra i gas, e aumenta scendendo lungo un gruppo, dall’alto verso il basso, però ci sono le dovute eccezioni (ad es. Hg), sono andamenti generici e non rigorosamente rispettati in tutti i gruppi/periodi.
Nel caso specifico il punto di ebollizione più elevato è quello dello Iodio.
risposta corretta D
54. In un reattore chiuso di 5,00 L sono contenute 1,40 mol di pentano e 3,50 mol di 2-metilbutano in
equilibrio a 310 K secondo la reazione
pentano (l) ⇄ 2-metilbutano (l)
Se in questo sistema si aggiungono 1,00 moli di pentano, quale sarà la concentrazione di pentano nella nuova condizione di equilibrio?
A) 0,15M
B) 0,88M
C) 0,34M
D) 0,79M
soluzione
l’ equilibrio del sistema è dato dalla Keq = [2-metilbutano]/[pentano]
| [2-metilbutano]= 3.50/5.00=0.700
[pentano]= 1.40/5.00=0.280 K = 0.700/0.280=2.50 Aggiungendo 1.00 moli di pentano si ha: moli di pentano = 1.00+ 1.40=2.40 [pentano]= 2.40/5.00=0.480 L’equilibrio si sposta a destra [pentano]= 0.480-x [2-metilbutano] = 0.700+x K = 2.50= 0.700+x/0.480-x 1.20 – 2.50x = 0.700 +x 0.500 = 3.50 x Da cui x = 0.143 [pentano]= 0.480-0.143=0.34 M |
quindi [2-metilbutano] = 3,5 moli/5 = 0,7 moli/l e [ pentano]= 1,4/5 = 0,28 moli/l
Keq= 0,7 / 0,28 = 2,5 se aggiungiamo 1 mole di pentano l’equilibrio si sposta verso destra
la nuova concentrazione di pentano è 1+1,4/5 = 0,48 M
pertanto, la nuova situazione è la seguente:
moli iniziali di pentano = 0,48
moli iniziali di 2 metilpentano = 0,7
moli di 2 metilpentano formate dopo l’aggiunta = X
moli all’equilibrio :
pentano = 0,48 – X moli di 2metilpentano = 0,7 + X
e conoscendo Keq si può calcolare X 0,7+X / 0,48-X = 2,5 da cui 0,7+X =2,5 (0,48-X) = 1,2 -2,5 X
1,2-0,7 = 2,5 X+X = 3,5 X pertanto X = 1,2-0,7/3,5 =0,5/3,5 X= 0,142
pertanto dopo aggiunta di 1 mole all’equilibrio avremo
0,48- 0,142 = 0,337 = 0,34 moli di pentano /litro
risposta corretta C
55. Il grado di dissociazione di un acido debole HA in una sua soluzione è 20%. Di quante volte bisogna aumentare il volume di tale soluzione, diluendo con H2O, perchè il grado di dissociazione diventi 50%?
A) 2 volte B) 4 volte C) 10 volte D) 3,5 volte
soluzione
HA ⇄ H+ + A-
1-α α α
Ka= α ² / 1- α Ka= (0,20)² / 1-0,20 = 0,04/0,8= 0,05 ricordando che V=1 litro
0,05 =[0,5 ² /(X)²] x X /0,5
0,05 x 0,5 = 0,25 /X
0,025 X = 0,25
X=0,25/0,025 = 10 lirti
Pertanto bisogna diluire la soluzione di acido dissociato al 20% di 10 volte perchè divenga dissociato al 50%
risposta corretta C
56 Un campione di minerale costituito da Au (s) e da SiO2 (s) ha volume = 38,0 mL e densità = 9,80 g mL–1. Calcolare la massa di Au (s) nel campione, sapendo che la densità dell’oro è 19,32 g/mL e quella della silice è 2,20 g/mL.
A) 330 g B) 318 g C) 341 g D) 326 g
soluzione
i grammi di oro sono forniti dal prodotto densità x volume = d x Voro
i grammi di SiO2 d x Vsil
se i volumi sono additivi, allora possiamo scrivere Vcamp = Voro + Vsil
peso del campione = peso oro + peso silice
d x Vcamp = d x Voro + d x Vsil
poichè Vcamp= Voro+ Vsil
Vsil=Vcamp – Voro
pertanto possiamo scrivere:
d x Vcamp = d x Voro+ d xVsil = d x Voro+ d x Vcamp -Voro
possiamo quindi calcolare il Voro
9,8 x 38 = 19,32 x Voro + 2,2 x (38 – Voro)
da cui Voro = 9,8 x 38- 2,2 38/ 19,32 – 2,2 = 16,87 ml
noto il volume dell’oro possiamo calcolare i grammi di oro:
grammi oro= densità oro x Voro
grammi oro = 19,32 x 16,87 = 325,9 g = 326 g
risposta corretta D
57. Una bombola contenente 8,0 m3 di una miscela gassosa misurati a 303 K contiene He e N2 alla pressione complessiva di 85,0 ·105 Pa. Calcolare la % V/V di He, nella miscela sapendo che nella bombola sono presenti 87,0 kg di N2.
A) 88,5% B) 45,3% C) 65,9% D) 77,8%
soluzione
per ottenere % (V/V) dobbiamo calcolare il volume a cui corrispondono 87Kg di N2 e poi per differenza calcoliamo % di He. 87Kg corrispondono a 87000 g pertanto
PV=nRT V = nRT/P = ( 87000/28) x 8,314 x303 / 85,0x 105
= 2,19 x 108 / 85,0x 105 = 0,920 m³ quindi la % in volume di N2 è 8,0 : 0,920 =100 :X X= 11,5%
pertanto la % in volume di He = 100-11,5= 88,5
58. Una soluzione acquosa di 0,5 L, che contiene 2 moli di un acido debole HA e 1 mole di NaOH, ha pH 5,4. Calcolare la costante acida di HA.
A) 7,3 ·10–5 B) 8,1 ·10–7 C) 4,0 ·10–6 D) 2,9 ·10–4
soluzione
siamo in presenza di un acido debole ed una base forte (soluzione tampone) pertanto sappiamo che [H+]= Ka Ca/Cs
essendo l’acido e la base discioti nello stesso volume di solvente si può sostituire alle concentrazioni il numero di moli cioè na ed nb pertanto [H+] = Ka na/nb
sappiamo che na =2 moli ma dopo l’aggiunta di 1 mole di base si ha na = 1 ed nb=1 pertanto [H+]=Ka
essendo PH =5,4 allora [H+] = 10-5,4 da cui [H+] = 3,99 x 10-6 pertanto Ka = 3,99 x 10-6
59. Per preparare una soluzione al 23,0% (m/m) di KF avendo a disposizione 90,0 g di una soluzione al 18,0% (m/m) dello stesso sale, quanti grammi di KF(s) occorre aggiungere?
A) 5,84 g B) 8,43 g C) 7,55 g D) 3,22 g
soluzione
sappiamo che %(m/m) = ( massa di soluto / massa di soluto + massa di solvente ) x 100
essendo la massa della soluzione pari a 90 g quindi la massa di soluto è data da 90 x 0,18 = 16,2 g
per conoscere quanti grammi occorre aggiungere a 16,2 g di soluto per avere una soluzione al 23 %(m/m)
si ricorre al calcolo seguente 16,2 + x/ 90 +x = =0,23
da cui 0,23 x (90+x) = 16,2 +x 20,7 +0,23X = 16,2 + X da cui 0,77 X = 20.7- 16,2 X= 4,5/ 0,77 = 5,84
60. Un minerale contiene il 95,0% (m/m) di HgO. Se 40,0 g di tale minerale sono decomposti secondo la reazione da bilanciare: HgO (s) → Hg (l) + O2 (g) si ottengono 0,0714 moli di O2. Calcolare la resa percentuale della reazione. A) 81,4 % B) 92,3 % C) 78,6 % D) 88,1 %
soluzione
la quantità di HgO iniziale è 40 x 0,95 = 38 g da cui si ottengono 0,0714 x 32 = 2,28 g di O2
dalla reazione 2HgO → 2Hg +O2 si evince che si dovrebbero ottenere 2 HgO :O2 = 38 : X X = 38 x 32 /( 2 x 216,6 ) = 2,8 g di O2
pertanto essendo la resa di una reazione (quantità sperimentale / quantità teorica) x 100 si ha (2,28 /2,8 ) x 100 = 81,4 %