LE CELLE GALVANICHE E FEM DI UNA PILA
Settembre 19, 2024CELLE GALVANICHE -PILE
Abbiamo visto in un altro articolo che per misurare il potenziale standard di un elettrodo è necessario costruire un apparato in cui due elettrodi vengono collegati sia da un ponte salino che da un filo elettrico.
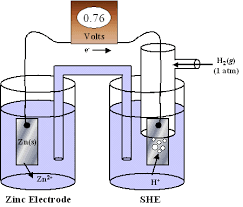
Abbiamo costruito, pertanto, un circuito elettrico in cui circolano elettroni che si muovono dall’elettrodo positivo(catodo) a quello negativo (anodo). Se nel circuito circolano elettroni questo movimento genera una corrente elettrica i il cui verso è però opposto al verso in cui si muovono gli elettroni. Se nel circuito indicato sopra, al posto del volmetro si pone una lampadina, essa si accenderà proprio perché nel circuito vi è una corrente elettrica.
Abbiamo costruito, quindi, un apparato, chiamato PILA o cella galvanica, che è in grado di produrre corrente sfruttando una differenza di potenziale tra il catodo e l’anodo: tale differenza si chiama FORZA ELETTROMOTRICE DELLA PILA e si indica sinteticamente con fem. Nella pila, pertanto, una reazione spontanea di ossidazione ed una reazione spontanea di riduzione producono un passaggio di corrente.Il catodo ha un potenziale maggiore di quello dell’anodo e la
fem =Ecatodo – Eanodo
COS’E’ UNA REAZIONE DI OSSIDORIDUZIONE?
un’ ossidazione consiste in una cessione di elettroni e ciò determina un aumento del numero di ossidazione
per esempio nella reazione Zn→ Zn+2 +2e
lo zinco si è ossidato aumentando il suo numero di ossidazione da 0 a +2
una riduzione consiste in un acquisto di elettroni con diminuzione del numero di ossidazione
per es
Zn+2 + 2 e → Zn in cui lo ione zinco si riduce formando Zn metallico con numero di ossidazione 0
MA COS’E’ IL NUMERO DI OSSIDAZIONE?
Il numero di ossidazione (n.o.) di un atomo è strettamente in relazione all’elettronegatività degli atomi cui esso è legato per formare una molecola. Il n.o. viene attribuito ad un atomo secondo le regole seguenti:
- Se un atomo si trova allo stato elementare ad es. Zn Al C ecc.oppure se è legato ad un altro atomo uguale es come H in H2, O in O2 N in N2, gli si attribuisce n.o. zero
- per ogni legame (2 elettroni) che lo unisce ad un altro più elettronegativo si attribuisce il valore +1
- per ogni legame (2 elettroni) che lo unisce ad un altro meno elettronegativo si attribuisce il valore -1
L’elettronegatività è la tendenza che un atomo esercita per attrarre verso di sè la nuvola elettronica del legame. Esistono diverse scale di elettronegatività, calcolate in modo diverso, ma qui adopereremo la scala di Pauling e diamo, di seguito, il valore dell’elettronegatività degli elementi più comuni.
fluoro F 4,0 cloro Cl 3,0
ossigeno O 3,5 zolfo S 2,5
litio Li 1,0 sodio Na 0,9
magnesio Mg 1,2 manganese Mn 1,5
carbonio C 2,5 idrogeno H 2,1
nichel Ni 1,8 piombo Pb 1,8
arsenico As 2,0 fosforo P 2,1
azoto N 3,0 Alluminio Al 1,5
bisogna fare attenzione a non confondere il n.o. con la valenza!
Infatti, la valenza è la capacità che ha un atomo di legarsi ad altri atomi.
Per mettere in evidenza la differenza consideriamo la molecola di alcol etilico
CH3-CH2-OH
l’atomo di C del CH2OH ha valenza 4 cioè si lega a 4 atomi : 1 C del CH3 due atomi di H (H2) ed un atomo di O (OH).
Calcoliamo il n.o. secondo le regole date sopra:
1- il C del CH2OH è legato ad un atomo dello stesso tipo (il C del CH3) e quindi si attribuisce il numero 0
2- Il C è legato a 2 atomi di H che possiedono elettronegatività 2,1 minore di quella del C che è 2,8 quindi si attribuisce – 1 per ogni H cioè in totale -2
3- il C è legato con 1 legame ad un atomo di O(dell’OH) che ha elettronegatività 3,5 che è maggiore di quella del C che è 2,8 quindi viene attribuito il valore +1
in conclusione il n.o del C legato all’OH nell’alcol etilico è -2 + 1 = -1 che come si vede è totalmente diverso dalla valenza che è sempre 4.
Facciamo un altro esempio :
consideriamo il C del gruppo COOH dell’acido acetico CH3-C=O OH :
il n.o. del C è così calcolato:
1- il C è legato ad un altro atomo di C e si attribuisce il valore 0
2- il C è legato al primo atomo di O con 2 legami quindi essendo l’elettronegatività dell’O maggiore di quella del C gli si attribuisce il valore +1 per ogni legame quindi +2
3- il C è legato anche all’ ossigeno del gruppo OH con 1 legame quindi gli si attribuisce il valore +1
in degfinitiva il C del COOH ha n.o. +2 +1 = +3
come si vede il C nel gruppo alcolico CH2OH è in uno stato ridotto -1 mentre il C nel gruppo acido COOH è in uno stato ossidato +3
La valenza è sempre 4.
Esercitazioni sul calcolo del n.o. degli atomi nei diversi composti.
Calcoliamo il n.o dello zolfo in H2S
lo zolfo è legato con 2 legami ad un atomo meno elettronegativo che è l’idrogeno quindi il suo n.o. è -2
calcoliamo il n.o. dell’idrogeno in NH3
l’azoto ha elettronegatività pari a 3,0 mentre l’idrogeno ha elettronegatività 2,1 quindi l’idrogeno è legato con 3 legami ad un atomo più elettronegativo per cui ogni atomo di H ha n.o.+1
L’azoto N a sua volta è legato a tre atomi di idrogeno che è meno elettronegativo dell’azoto per cui il suo n.o. è – 3
pertanto in NH3 il n.o. N = -3 ed il n.o. H =+1
calcolare il n.o. dell’idrogeno nell’idruro metallico LiH
il litio ha un’elettronegatività inferiore a quella dell’idrogeno per cui
l’ H in LiH ha n.o. -1
(in tutti gli idruri metallici l’idrogeno ha n.o. -1 )
calcolare il n.o. del fosforo in PH3 (fosfina) ed AsH3(arsina)
Nel caso di PH3 e AsH3 però non ci troviamo dinanzi a idruri metallici essendo sia P che As non metalli che hanno elettronegatività uguale nel caso di P e minore nel caso di As ed hanno un legame covalente.
In relazione quanto sopra PH3 NON forma H2 con l’acqua PH3 + H2O ⇄ PH4+ + OH– Kb = 4 · 10-28
PH3 + H2O ⇄ PH2.- + H3O+ Ka = 1.6 · 10-2
Nelle soluzioni acquose la fosfina PH3 ha una scarsa tendenza a protonarsi o a deprotonarsi come può essere rilevato dai bassissimi valori delle relative costanti di equilibrio.
Pertanto il n.o. dell’H in PH3 è +1 mentre il n.o. del P è -3
Analogamente l’As in AsH3 ha n.o.-3
( questo metodo è valido anche per NH3)
Cr3+ +S2O8 -2→ Cr2O7-2 + SO4-2
Per iniziare, individuiamo il numero di ossidazione degli elementi implicati nella reazione:
2 atomi di Cr+3 si ossidano per formare Cr2O7-2 in cui Cr ha n.o. +6
per quanto riguarda S2O8-2 possiamo notare che secondo il metodo di calcolo del n.o. visto sopra lo zolfo ha n.o. +6 in S2O8-2 ed ha anche n.o. +6 in SO4-2.
Perchè S2O8-2 agisce da ossidante se lo zolfo non interviene nella reazione :
per rispondere a questa domanda dobbiamo guardare alla struttura di S2O8-2 infatti
la struttura del S2O8-2 è:
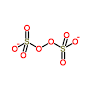
dove è posibile vedere che 2 degli atomi di O sono legati tra loro come nei perossidi (ad es. H2O2 ) per cui ogni atomo di O ha n.o. -1 (come in un perossido) e si deduce che nel composto S2O8-2 l’ossidante è O2-2 in cui ogni atomo di O ha n.o. -1 che nella reazione forma 2 O -2 acquistando 2 elettroni e formando SO4-2.
Pertanto la semireazione di riduzione è:
S2O8-2 + 2e- = 2SO4-2
e nella semireazione di ossidazione.
2Cr(+3) = Cr2O7(-2)
il cromo si ossida, passando da n.o. +3 a n.o. +6, cedendo in totale 2×3 = 6e-
2Cr+3→ Cr2O7-2 + 6e-
poichè la reazione avviene in ambiente acido, aggiungiamo H+ dalla parte in cui vi è il maggior numero di atomi di ossigeno quindi dove c’è Cr2O7-2
2Cr+3 → Cr2O7-2 + 6e- + 14H+
adesso aggiungiamo H2O dalla parte della reazione in cui vi è minore quantità di ossigeno ed in numero pari alla metà dehli atomi di idrogeno aggiunti
2Cr+3 + 7H2O → Cr2O7-2 + 6e- + 14H+
possiamo quindi riassumere scrivendo le due semireazioni
S2O8-2 + 6e- → 2SO4-2
2Cr+3 + 7H2O → Cr2O7 -2 + 6e- + 14H+
moltiplichiamo la prima semireazione per il numero di elettroni della seconda e la seconda per il numero di elettroni della prima e semplifichiamo
3 [6[S2O8-2 + 6e- → 2SO4-2
1 [-3[2Cr+3 + 7H2O → Cr2O7 -2 + 6e- + 14H+
______________________________________
3S2O8-2 + 2 Cr+3 + 7H2O →2SO4-2 + Cr2O7 -2 + 14H+
abbiamo così ottenuto i coefficienti della reazione per cui possiamo scrivere (ricordando che l’ambiente è acido):
2CrCl3 +3Na2S2O8 + 7 H2O → Na2Cr2O7 + 2 Na2SO4 + 4 H2SO4 + 6 HCl
| Sistema ossidante | Sistema riducente | Potenziale | ||||||
| in volts | ||||||||
| (vs elettrodo | ||||||||
| Oss + ne ~ Rid | normale a | |||||||
| idrogeno = O) | ||||||||
| •• | 1/2 F2 + e | F- | + 2.85 | |||||
| 1/2 S2O8 + e | SO4= | + 2.01 | ||||||
| H202 + 2H + + 2e | 2H2O | + 1.77 | ||||||
| Pb02 + 4H + + 2e | Pb2+ + 2H2O | + 1.46 | ||||||
| Mn04– + 4H + + 3e | MnO2 + 2H2O | + 1.63 | C | |||||
| Mn04– + 8H + | + 5e | Mn2+ + 4H2O | + 1.52 | |||||
| Au +3 + 3e | Au | + 1.42 | r | |||||
| 1/2 CI2 + e | CI- | + 1.36 | e | |||||
| 1/2 Cr207-2 + 7H + + 3e | Cr3+ | + 7/2 H2O | + 1.33 | s | ||||
| 1/2 02 + 2H + + 2e | H20 | + 1.23 | c | |||||
| 1/2 Br2 + e | Br- | + 107 | e | |||||
| N03– + 4H + + 3e | NO + 2H2O | + 0.96 | n | |||||
| O2 + 4H + (10 – 7) + 4e | 2H2O | + 0.81 | t | |||||
| Ag+ + e | Ag | + 0.80 | e | |||||
| Fe3+ + e | Fe2+ | + 0.77 | ||||||
| 1/212 + e | 1- | + 0.54 | P | |||||
| Cu2+ + 2e | Cu | + 0.34 | o | |||||
| 1/2 N2 + 4H + | + 3e | NH4+ | + 0.27 | t | ||||
| Sn4+ + 2e | Sn2+ | + 0.15 | e | |||||
| S + 2H + + 2e | H2S | + 0.14 | r | |||||
| H+ + e | 1/2 H2 | 0.00 | e | |||||
| Pb2+ + 2e | Pb | – 0.13 | ||||||
| Sn2+ + 2e | Sn | – 0.14 | r | |||||
| Ni2+ + 2e | Ni | – 0.25 | i | |||||
| Cd2+ + 2e | Cd | – 0.40 | d | |||||
| Fe2+ + 2e | Fe | – 0.44 | u | |||||
| Cr3+ + 3e | Cr | – 0.74 | c | |||||
| Zn2+ + 2e | Zn | – 0.76 | e | |||||
| Mn2+ + 2e | Mn | – 1.18 | n | |||||
| A13+ + 3e | AI | – 1.66 | t | |||||
| Mg2+ + 2e | Mg | – 2.37 | e | |||||
| Na+ + e | Na | – 2.71 | ||||||
| Ca2+ + 2e | Ca | – 2.87 | ||||||
| K+ | + e | K | – 2.92 | |||||
| Li + + e | Li | – 3.02 | I ~ | |||||
pertanto Ecu = E°+0,591/2 logn 10-3 = 0,34 – 3 x 0,295
Ecu= 0,34 – 0,885 = 0,252 V
Ezn = E° + 0,0591/2 log 10-1 = – 0,7628 – 1 x 0,0295
Ezn = – 0,7628 – 0,0295= – 0, 7923 V
pertanto la f.e.m. = Ecatodo – Eanodo = Ecu – Ezn = 0,252 – (- 0,7923)= 1,044 V
Le pile di questo tipo sono dette PILE A CONCENTRAZIONE.
Calcoliamo la f.e.m. della pila Cd-Ag in cui [Ag+] =0,1 M e la soluzione di Cd+2 è costituita da Cd(NO3)2 0,5M dissociato per il 48% .E°Cd=-0,40 V E°Ag+= 0,80 V
Conosciamo la [Ag+] =0,1M e dobbiamo calcolare la [Cd+2]
Essendo Cd(NO3)2 dissociato del 48% allora la concentrazione del Cd+2 è calcolata dalla proporzione
se in 100 vi sono 48 patrti di Cd+2 in una concentrazione 0,5M vi sarà [Cd+2]
100 :48 = 0,5 :X X = 0,48 x0,5 = 0,24 M
pertanto Ecd = E° + 0,0591/2 log 2,5 x 10-1 = -0,40 +0,0295 x -1 x log2,5 = 0,40-0,0196
Ecd= – 0,419 V
EAg = Eé + 0,0591/1 log 10-1 = 0,80 – 0,006
EAg = 0,74 V
In questo caso il catodo è l’elettrodo positivo cioè Ag/Ag+ quindi
f.e.m. = 0,74 – ( -0,419) = 0,74 + 0,419 = 1,159 V
Calcoliamo la f.e.m. della pila costituita dallo stesso metallo immerso in due diverse soluzioni con concentrazione ionica differente:
calcolare la f.e.m. della seguente pila : Sn/Sn+2 0,5N || sn+2 0,75 N / Sn
E2= E° +RT/nF log C2
E1= E° +RT/nF logC1
E2- E1 = RT/nF (logC2 – log C1)
la f.e.m. = E2-E1 = RT/nF log C1/C2
f.e.m.= 0,0591 log 0,75/0,5 = 0,0295 x 0,176 = 0,0052 V
TIPI DI ELTTRODI UTILIZZATI IN POTENZIOMETRIA
Dagli esempi visti sopra, vi sono alcuni tipi di elettrodo utilizzati per misurare la concentrazione di specie ioniche in soluzione e sono chiamati Elettrodi Indicatori L’elettrodo indicatore è un elettrodo il cui potenziale varia, in maniera rapida e riproducibile, in funzione dell’ attività (concentrazione x coeff. attività) dello ione che si vuole determinare. Esistono due classi generali di elettrodi indicatori: metallici e a membrana.
Elettrodi indicatori metallici
Elettrodo di I specie
E‘ costituito da un metallo in presenza di un suo sale, funziona come indicatore dei propri cationi. Ad esempio un elettrodo di rame immerso in una soluzione di CuSO4 può essere utilizzato per determinare l’attività del Cu2+,poiché il suo potenziale è
E =E°Cu2+-k/2 · log[1/(aCu2+)]
Tuttavia non tutti i metalli possono essere utilizzati come indicatori dei propri cationi, poiché non tutti hanno un comportamento redox reversibile.
Elettrodo di II specie
E’ costituito da un metallo in presenza di un suo sale come corpo di fondo. In questo caso l’elettrodo funziona come indicatore dell’anione. Ad esempio l’elettrodo ad Ag/AgCl può essere utilizzato per determinare l’attività dello ione Cl-,poiché il suo potenziale è:
E =E°Ag/AgCl – k · log[(aCl-)]
Elettrodo di III specie
E’ un particolare tipo di elettrodo di prima specie in cui l’attività del catione che compare nella reazione d’elettrodo dipende dall’attività di un altro catione presente in soluzione. Funziona quindi come indicatore per entrambi i cationi. Ad esempio un elettrodo di Zn immerso in una soluzione di un sale di calcio in cui sono presenti come corpo di fondo ossalato di calcio (CaOx) e ossalato di zinco (ZnOx) ha potenziale
E =E°Zn2+ – 0,06/2 · log[1/(aZn2+)] , dove però
1) aZn2+ dipende dal prodotto di solubilità di ZnOx secondo la
Kps(ZnOx) = aZn2+·aOx2) aCa2+
2) dipende dal prodotto di solubilità di CaOx secondo la
Kps(CaOx) = aCa2+·aOx2-
3) aOx2-=Kps(ZnOx) / aZn2+ = Kps(CaOx) / aCa2+ → aZn2+=
=[Ks(ZnOx)/Kps(CaOx)]·aCa2+ = K· aCa2+
in definitiva aZn2+ = K· aCa2+,
quindi l’elettrodo di Zn, in questo caso, può essere utilizzato per determinare l’attività del calcio.
Elettrodo redox
costituito da un metallo inerte immerso in una soluzione che contiene una coppia redox. Ad esempio il potenziale di un filo di Pt immerso in una soluzione che contiene Fe3+ e Fe2+ ha potenziale: E =E°Fe2+/Fe3+-0,059 · log[aFe2+/(aFe3+)]
Elettrodo a gas
particolare elettrodo redox costituito da un gas (H2, Cl2) adsorbito sulla superficie di un metallo inerte immerso in una soluzione di suoi ioni (H+, Cl-).
Ad esempio il potenziale dell’elettrodo a idrogeno (non standard) è:
E =EHSE – 0,06 log[(pH2)1/2/(aH+)]
Elettrodi a membrana o ISE (Ion Selective Electode)
Un elettrodo ionoselettivo risponde selettivamente ad una determinata specie iin soluzione. In generale gli ISE sono costituiti da un elettrodo di prima o seconda specie (indicatore interno) la cui soluzione dello ione caratteristico (a concentrazione nota e costante) è mantenuta separata, attraverso una membrana ionoselettiva, dalla soluzione esterna in cui è presente lo stesso ione a concentrazione incognita.
Una membrana ionoselettiva per la specie i è una membrana che permette selettivamente il passaggio della specie i, o più correttamente è una membrana per la quale il numero di trasporto i per la specie iW1. Le membrane IS differiscono tra loro per la composizione chimica e fisica: esistono infatti membrane in vetro, cristalline, liquide e biocatalitiche (la più nota è quella in vetro usata nell’elettrodo a vetro per la misura del pH).
Il meccanismo di funzionamento degli ISE è completamente diverso rispetto a quello degli indicatori metallici: il potenziale di un ISE è determinato infatti dalla differente attività dello ione i che si vuole determinare ai due lati di una membrana ionoselettiva. Poiché l’ ISE è costruito in modo che l’attività di i sia costante all’interno della membrana si può dimostrare che il potenziale dell’ISE (per convenzione sempre polo positivo della pila) dipende solo dall’attività della specie inella soluzione incognita ed è:
E =U+k/zi ·log (ai)= U – k/zi ·paione
dove U è una costante che dipende da elettrodi e soluzioni di riferimento interni ed esterni, mentre zi èla carica della specie ionica i presa con il suo segno.
Di conseguenza paione nella soluzione ad attività ionica ai incognita sarà:
pai = –(E–U)/ k/zi Poiché in generale risulta difficile quantificare con esattezza il valore della costante U, nelle determinazioni dirette di attività si usa “eliminarla” tramite le operazioni di taratura.
esercizi
1-Calcolare il potenziale della coppia Zn2+/Zn a 25°C per una semipila formata da una lamina di zinco immersa in una soluzione 2.5· 10-2 molare di Zn2+ sapendo che E°= -0.76V .
soluzione
ricordando che
E = E° +0.059 /2 log[Zn+2 ][ Zn] = – 0.76 0.059/2 log (2.5· 10-2) = -0.807 V
2) Calcolare il potenziale di un elettrodo di Pt che pesca in una soluzione a pH = 1 e contenente KMnO4 2M e MnSO4 2M. La reazione (da bilanciare) è:
MnO4 – + H+ → Mn2+ + H2O
soluzione
Mn si riduce e passa dallo stato di ossidazione +7 a +2 quindi acquista 5 e-. Si devono mettere 8 ioni H+ per il bilancio di carica.
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
Data l’equazione di Nernst, il potenziale è:
E= E°MnO4-/ Mn2+ + 0,059/5 log [MnO4-][H+]8/[Mn+2] = 1.51 + 0,059/5 log[H+]8 = 1.51 + 8x 0,059/5 PH = 1.416 V
3) Una pila è così formata:
Pt | [Sn4+] = 1M, [Sn2+] = 1M || [Zn2+] = 1M | Pt
Determinare la f.e.m. della pila.
soluzione
Le reazioni che avvengono sono:
Sn4++2e- → Sn2+ E° = 0.15V
Zn2++2e- → Zn E° = -0.76V
La reazione complessiva è:
Sn4+ + 2e- → Sn2+
Zn → Zn2+ + 2e-
_____________________
Zn +Sn4+ → Sn2+ + Zn2+
f.e.m.= E°Sn4+/Sn2+ +0.059/2 log[Sn+4]/[Sn+2] – E°Zn2+/Zn – log 0,059 / 2 log[Zn+2]
f.e.m.= ΔE° +0,059/2 log [Sn+4]/[Sn+2][Zn+2] = 0.15 + 0.76 +0,059/2 log 1 = 0.91V
4) Data la seguente pila:
Pb | PbCl2 (V=1L, satura) || [Ag+]=0.5M |Ag
Calcolare f.e.m. della pila e la f.e.m. quando alla soluzione di sinistra viene aggiunta una mole
di NaCl. (E°Pb2+/Pb=-0.13V; E°Ag+/Ag=0.8V; KpsPbCl2=2.4·10-4)
soluzione
PbCl2(s) →Pb2+(sol) + 2Cl-(sol) se poniamo Pb+2 = x allora 2Cl = 2x
x 2x
il prodotto di solubilità è
Kps = x· (2x)2
x = 3√Kps/4 = 0.039 M
f.e.m.= 0.8 + 0.059 log[Ag+] + 0.13 – 0.059 /2 log[Pb2+] = 0.8 – 0.0178 + 0.13 + 0.0416 = 0.953V
Dopo l’aggiunta di NaCl si ha [Cl-]=1M
Kps = x (1)2 , da cxui si ha x = [Pb2+] = 2.4 · 10-4
f.e.m.= 0.8 – 0.0178 + 0.13 + 0.107 = 1.02 V
