ENZIMI IN CHIMICA CLINICA
Settembre 19, 2024IL LABORATORIO DI DIAGNOSTICA ENZIMATICA
L’analisi enzimatica viene giornalmente utilizzata nei laboratori ospedalieri e laboratori privati quale mezzo, spesso fondamentale, per la diagnosi di molte delle malattie che colpiscono gli esseri umani ed in particolare si valutano:
1- produzione di enzima
2- quantità di enzima rilasciata dalle cellule nei liquidi biologici in seguito ad un danno cellulare (ad esempio danni epatici oppure infarto del miocardio)
3- si misura la quantità di enzima prodotto nelle malattie metabolico- genetiche quali ad esempio la fenilchetonuria
L’attività enzimatica viene misurata valutando la quantità di substrato che l’enzima presente nel campione biologico trasforma nell’unità di tempo.
Non tutti gli enzimi vengono però dosati nell’impiego di routine in laboratorio a fini diagnostici,ma solo alcuni che riguardano enzimi specifici plasmatici ad es.trombina, fattore X, Fattore XII, fibrinolitici ecc oppure enzimi escreti quali colinesterasi, amilasi,lipasi ecc ed enzimi cellulari.
Gli aumenti o diminuzioni dei valori di attività enzimatiche nel siero sono spesso correlate ad alterazioni della funzionalità cellulare.
Meccanismo normale della distribuzione degli enzimi nel sangue :
L’immissione in circolo di enzima da parte delle cellule viene bilanciata dalla corrispondente eliminazione sia per filtrazione renale che per catabolismo o inattivazione, che ne mantengono costante la concentrazione sierica. Se vi è un aumento nella sintesi cellulare degli enzimi, se vi sono alterazioni della membrana cellulare,se vi sono necrosi degli organelli di membrana allora gli enzimi vengono immessi in circolo e poiché i sistemi di eliminazione non sono in grado di smaltire l’eccesso, la concentrazione degli enzimi sierici aumenta. Il tasso ematico normale degli enzimi è, pertanto, il risultato della loro immissione in circolo da parte delle cellule nel corso del metabolismo, il loro catabolismo e la loro escrezione da parte di rene e fegato. Il livello enzimatico nel plasma dipende dalla velocità di immissione in circolo cioè sia dalla rapidità con cui la cellula si danneggia che dall’ estensione della lesione, ma anche dalla velocità con cui l’enzima viene catabolizzato. In alcuni casi si osserva che anche una minima quantità di cellule (come ad esempio nel fegato colpito dal virus dell’epatite) può fare elevare di molto la quantità di enzima sierico. In altri casi come nella cirrosi epatica, le cellule subiscono un danneggiamento meno rapido ma progressivo e lento per cui si ha ugualmente un aumento di enzima sierico ma meno significante. L’aumento è dovuto al tessuto patologico (es. fosfatasi acida nel carcinoma della prostata) o alla lesione ( transaminasi nell’infarto del miocardio) o per ostacolato deflusso (fosfatasi alcalina nelle ostruzioni delle vie biliari), L’attività enzimatica, si esprime in unità internazionali (U.I.) ed una U.I. equivale alla quantità di enzima che catalizza la conversione di 1 µmole (micromole) di substrato per minuto in condizioni definite di temperatura, pH, e concentrazione del substrato.Il pH ottimale viene accuratamente mantenuto con l’utilizzo di tamponi appropriati. Nella misura dell’enzima in laboratorio occorre considerare che questo deve essere il fattore limitante della reazione e pertanto, il substrato deve essere presente in eccesso.
Per essere dosati nel siero, urina o altri fluidi, gli enzimi devono essere stabili durante la conservazione e l’analisi del campione devono avere un valore significativo dal punto di vita diagnostico e devono essere facilmente dosabili.La concentrazione degli enzimi viene calcolata in base alla loro attività enzimatica che può essere effettuata per un tempo prestabilito oppure in continuo.
Nel primo caso la miscela di reazione viene fatta reagire per un tempo prestabilito, finito il quale si determina la quantità di prodotto ottenuto o di substrato consumato.
Nel secondo caso la reazione viene seguita in continuo cioè si effettua un’analisi cinetica mediante misurazioni successive ad intervalli di tempo prestabiliti.
Le misurazioni in continuo sono preferibili perché permettono di individuare qualsiasi deviazione dalla linearità. L’esempio più comune di deviazione dalla linearità si verifica quando la concentrazione di E nel campione è cosi’ elevata che consuma tutto il substrato in tempi rapidissimi.
La misura si effettua in unita’ internazionali (UI): 1UI è quella quantità di enzima che catalizza la trasformazione di 1 μmole di substrato in 1 minuto. La concentrazione enzimatica viene espressa come UI/L.
Le misure di concentrazione di un enzima possono essere eseguite utilizzando un substrato incolore che forma un prodotto colorato per azione dell’enzima come ad es. l’attività della fosfatasi si misura seguendo la formazione del prodotto colorato 4 nitrofenolato colorato che si forma dal substrato incolore 4nitrofenilfosfato per azione della fosfatasi che agisce sul fosfato di questo composto.
Un altro metodo molto utilizzato in chimica clinica, consiste nell’ accoppiare la reazione primaria dell’enzima con una seconda reazione che utilizza NAD- o NADP- e seguendo la concentrazione di questa specie per via spettrofotometrica. Questo metodo si utilizza quando il prodotto dell’enzima che viene dosato non è distinguibile otticamente dal substrato.
E1 E2
L → S → P
dove E1 = enzima da dosare ed E2 = enzima ausiliario
La reazione catalizzata da E1 deve essere di ordine zero rispetto a [L] e si realizza con un eccesso di L ([L]>> KmL
La reazione catalizzata da E2 deve essere di primo ordine rispetto a [S] e si realizza utilizzando E2 in largo eccesso ([S]<<Km ed entrambe le reazioni devono essere irreversibili+
REAZIONI UTILIZZATE PER VALUTARE LA FUNZIONALITA’ EPATICA
Come indice di funzionalità epatica e muscolare si misurano gli enzimi
AST (GOT) = Aspartato aminotrasferasi i cui valori normali nel siero sono (8-20 UI/l)
ALT = alanina amminotrasferasi
l’ AST è localizzata soprattutto nei tessuti cardiaco, scheletrico ed epatico.La concentrazione intracellulare di AST è 1000 volte piu’ elevata rispetto alla concentrazione extracellulare. Nel siero si ha un aumento nell’epatite acuta e cronica, nell’infarto del miocardio, nella distrofia muscolare, nella pancreatite acuta.Dopo danni gravi, i livelli di AST possono alzarsi in 6/10 ore e rimanere alti per circa 4 giorni. AST è utile nella diagnosi e nel controllo della terapia delle malattie epatiche infatti nell’epatite acuta aumenta in tempi brevi (150-500 UI/l) mentre in quella cronica cronica l’aumento risulta inferiore (20-100 UI/l. La reazione che si utilizza per la misura dell’AST è:
AST
Aspartato + a-chetoglutarato ——> ossalacetato + glutammato
MDH
Ossalacetato + NADH + H+ ——> malato + NAD+
MDH= malatodeidrogenasi
in questo caso si dosa NADH che si segue spettrofotometricamente a 340 nm .
Per quanto attiene il dosaggio di ALT si utilizza la reazione:
ALT
Alanina + a-chetoglutarato ———-> piruvato + glutammato
LDH
Piruvato + NADH + H+ ——–> Lattato + NAD+
LDH = Lattico Deidrogenasi
ALT = alanintransferasi
Anche in questo caso si segue NADH a 340 nm.
I valori normali sono 10-25 UI/l
E’ localizzata soprattutto nel tessuto epatico ed aumenta nell’epatite acuta e cronica.Nel danno infiammatorio acuto il livelli di ALT sono superiori ai livelli di AST e rimangono elevati nel sangue piu’ a lungo.
Un altro esame utilizzato per valutare la funzionalità epatica è il dosaggio dell’ enzima γGT g-glutamil trasferasi, un enzima presente in tutti i tessuti, particolarmente nel rene e nel fegato, a livello dei dotti biliari. Il valore aumenta nell’ostruzione dei dotti biliari e nell’ abuso cronico di alcol infatti negli alcolisti, la γGT sierica aumenta per un meccanismo di induzione enzimatica, quindi indipendentemente dalla presenza o meno di danno epatico alcol-correlato (se presente, comunque, l’aumento della γGT è più consistente).
Il dosaggio delle amilasi è utilizzato quale indice di funzionalità pancreatica ed i valori normali sono tra 100-300 UI/L . Le amilasi sono enzimi idrolitici implicati nella scissione dei polisaccaridi e vengono prodotti in vari organi da cui prendono il nome (isoenzimi) : 1)salivare (ptialina) presente anche nel sudore, lacrime, liquido amniotico, 2)pancreatica, viene rilasciata nell’intestino L’amilasi aumenta nelle pancreatiti acute (livelli 20-30 volte superiore rispetto agli individui sani, raggiunge il massimo dopo 24 h).
Anche le lipasi sono utilizzate per valutare la funzionalità pancreatica ed i Valori normali sono tra 100-300 UI/L e sono enzimi che vengono prodotti nel pancreas e catalizzano l’idrolisi dei trigliceridi. La LIPASI aumenta nelle pancreatiti acute (è più specifica dell’amilasi e si libera più tardivamente permanendo più a lungo in circolo);
Il dosaggio della lattico deidrogenasi LDH nel siero si effettua mediante la reazione:
Piruvato + NADH + H+ ———> Lattato + NAD+
Valori ematici normali (100-200 UI/l) ed aumentano nelle patologie epatiche, cardiache, muscolari, renali ed ematologiche. Molti farmaci quali anestetici, dicumarolici, nitrofurantoina, ecc. possono anche provocare un aumento di LDH e gli eritrociti hanno una concentrazione di LDH 100-150 volte maggiore rispetto a quella che si trova nel sangue.
ISOENZIMI
Molto spesso in chimica clinica si dosano i cosiddetti isoenzimi che hanno la stessa origine genetica dell’enzima corrispondente e catalizzano la stessa reazione, ma differiscono nella struttura. Un tipico esempio sono le creatinfosfochinasi CPK di cui si dosa l’isoenzima CKMB più specifico nell’infarto del miocardio del CPK totale ; spesso possiedono Km, Vmax diverse dagli enzimi corrispondenti e sono presenti in tessuti diversi (cuore, fegato, ecc.).L’’isoenzima CPKMB compare nel siero generalmente 4-8 ore dopo l’episodio acuto e raggiunge un massimo dopo 24 ore.
Glucochinasi ed Esochinasi sono anch’essi isoenzimi e catalizzano la fosforilazione del glucosio
Glucose + ATP ——> Glucose 6 P + ADP
esistono IV tipi di esochinasi I,II,III, IV di cui la forma I esiste nel tessuto mammario ed in genere in tutte le cellule, reagisce anche con altri monosaccaridi ed ha Km = 0.1 mM , non è indotta dall’ insulina e non è inibita da G6P,mentre la forma IV è presente solo nel fegato,reagisce solo con glucosio ed ha Km = 10 mM è indotta dall’ insulina e non è inibita da G6P.
Poiché la glucochinasi non è inibita dal glucosio6fosfato, in condizioni di alte concentrazioni di glucosio, questo enzima continua a fosforilare il glucosio che può essere utilizzato per la sintesi del glicogeno nel fegato. Inoltre, poiché Glucochinase ha un alto Km, la sua attività non compromette la fornitura di glucosio ad altri organi; in altre parole, se la glucochinasi avesse un Km basso, continuerebbe a convertire il glucosio in glucosio 6 fosfato nel fegato, rendendo il glucosio non disponibile per altri organi (ricorda che dopo i pasti il glucosio arriva prima al fegato attraverso il sistema portale),
Anche per l’LDH si dosano diversi isoenzimi in varie condizioni patologiche.La Lattico Deidrogenasi (LDH) è un tetramero costituito da 2 tipi di subunità (H e M), L’Isoenzima H4 (HHHH) si trova nel cuore e l’isoenzima M4 (MMMM) nel muscolo scheletrico.
ESEMPIO DI DOSAGGIO ENZIMATICO NEI LIQUIDI BIOLOGICI
ANALISI DEL GLUCOSIO
Milioni di persone nel mondo soffrono di diabete,una malattia che provoca elevati livelli di glucosio nel sangue a causa di malfunzionamento delle cellule del pancreas per cui è necessario avere un test semplice, specifico e rapido per gestire i livelli di glucosio.Le analisi enzimatiche del glucosio sono fondamentalmente basate sui due metodi comunemente usati in chimica clinica, il metodo alla glucosio- oxidasi ed il metodo all’ esokinasi. Il controllo della temperatura, per queste reazioni enzimatiche, non è critico per cui è possibile effettuarle in cuvette a temperatura ambiente e con piccole quantità di reagenti.
OSSIDAZIONE DEL GLUCOSIO
L' enzima glucosio-ossidasi e' specifico per il d-glucosio
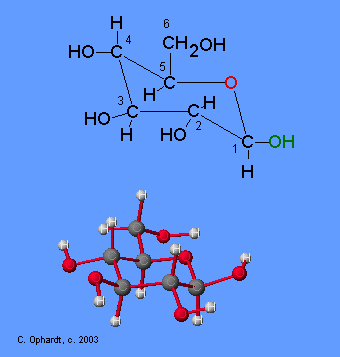
Il Glucosio è uno zucchero riducente quindi può essere ossidato e per questo si usa la glucosio-ossidasi che trasforma il beta-D-glucosio ad acido D-gluconico . La forma α del D-glucosio è rapidamente convertita alla forma β per cui tutto il D-Glucosio viene ossidato dall’enzima.
L’Ossigeno biatomico dall’aria (O2) è l’agente ossidante che agisce sul glucosio e durante la reazione, l’anello si apre ed il gruppo aldeidico CHO che si trova sul carbonio n.1 è convertito ad acido di D-gluconico. Nello stesso tempo, l’ossigeno in presenza di acqua è convertito a perossido di idrogeno. Tutti i reagenti ed i prodotti della reazione però sono incolori, per cui non sarebbe possibile seguire la reazione con alcun mezzo per cui è necessario un altro passo che è quello di produrre un colore in modo da seguire la reazione.
REAZIONE UTILIZZATA PER PRODURRE IL COLORE
Molti metodi sono possibili per ottenere un colore, ma nella maggior parte dei casi si fa reagire il perossido di idrogeno con una sostanza che forma un prodotto colorato. Un esempio è la reazione del perossido di idrogeno con l’enzima perossidasi che in presenza di o-Toluidine o 2-methylaniline forma un composto colorato. E’ possibile usare il 4-aminofenazone e fenolo per formare un colorante rosso 4-(p-benzochinone-monoimino)-fenazone, che viene misurato spettrofotometricamente a 505 nm.
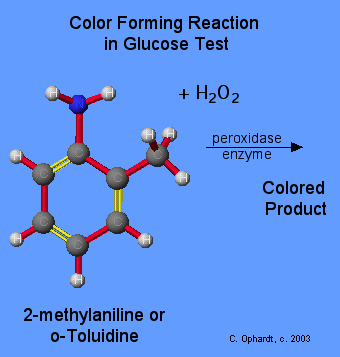
La concentrazione del glucosio è in relazione diretta all’intensità del colore prodotto, per cui la misura viene fatta con uno spettrofotometro secondo la legge di Lambert e Beer.
Riassumendo:
D-Glucosio +O2 +H2O + GOD→ gluconolattone+H2O2
H2O2 +4aminofenazone+fenolo +POD → colorante rosso (λ =505 nm)
METODO ALL’ESOKINASI
Nel metodo all’ esokinasi il glucosio si fa reagire con ATP ed esokinasi (HK) e si forma il glucosio-6-fosfato che viene ossidato dall’NAD (Nicotinammide-Adenin-Dinucleotide)

in una reazione catalizzata da glucosio-6-fosfato deidrogenasi (G6PD) per dare NADH che viene misurato a 340 nm.
Glucosio+ATP+HK → glucosio-6-PO4 + ADP
lucosio-6-PO4 +NAD + G6PD → 6-fosfogluconato +NADH
PROCEDURA SPERIMENTALE
Materiali
Reagente (Esokinasi)
100 mmol/l Tris-HCl tampone, pH 7.8, contenente 1 mmol/l magnesio acetate; 0.66 mmol/l NAD+, 0.40 mmol/l ATP, hexokinase (EC 2.7.1.1) 0.66 U/ml; glucosio-6-fosfato deidrogenasi (EC 1.1.1.49) 0.66 U/ml.
Soluzione standard di glucosio 10mmoli/l
Siero
Metodica Analitica
Marcare tre cuvette: 1 Banco 2 Standard 3 Campione
pipettare 2 ml di reagente esokinasi preparato come sopra descritto nelle 3 cuvette
pipettare 20μl di H2O nella cuvetta “Bianco”
Pipettare 20μl di soluzione standard 10mmoli/l nella rispettiva cuvetta
Pipettare 20 μl di siero nella cuvetta “campione“
mescolare gentilmente
trasferire le cuvette allo spettrofotometro e misurare a 340 nm usando il ianco per azzerare lo strumento.
Ripetere la lettura ad intervalli di 1 minuto sino a che il valore di lettura rimane costante.
Porre in grafico l’assorbanza (in ordinate) ed il tempo (in ascisse ) e determinare il punto finale dell’ assorbanza sia per lo standard che per il campione (cioè quando si raggiunge il plateau).
