ELETTROLISI : TEORIA ED ESERCIZI
Settembre 19, 2024ELETTROLISI
Prima di procedere ricordiamo le unità di misura in elettricità.
Differenza di potenziale ————> VOLT
Intensità di corrente ——————> AMPERE
Energia ———————————> JOULE
Potenza ———————————> WATT
Resistenza ——————————> OHM
Watt = ampere x volt = jaule /secondo
Coulomb = ampere x secondo oppure coulomb= Jaule/volt
Ohm = volt/ampere
Ampere= watt / ampere x ohm infatti Watt= ampere x volt / ampere x ohm
Cioè ampere = ampere x ampere x ohm /ampere x ohm da cui
Ampere = ampere=watt/ampere x ohm
Volt = jaule/ ampere x secondo
Ohm = Joule /Ampere²x secondo
1 Faraday = 96500 Coulomb/mole di elettroni
Esercizi sulle unità di misura
1-Quanta energia si spende quando si fa passare per un tempo pari a 100 secondi una corrente di 1 ampere sotto il potenziale di 115 Volts ?
Soluzione
Abbiamo visto che Volt = jaule/ ampere x secondo
pertanto
Jaule = Volts x Ampere x secondo
Quindi Jaules = 115V x 1 x 100 = 11500 J cioè 11500/1000= 11,5 KJ
2- Dalla definizione di Faraday, calcolare la carica dell’elettrone
Soluzione
Essendo 1 mole di elettroni pari a 6,02 x 1023 elettroni,
se 96500 C corrispondono alla carica elettrica di 6,02 x 1023 elettroni quanti Coulomb corrispondono alla carica di 1 elettrone? cioè:
96550: 6,02 x 1023 = X : 1
X= 96500 / 6,02 x 1023 = 1,60 x 10-19 Coulomb che è la carica di 1 elettrone elettrone
3- Una lampada consuma 2 A (Ampere) di corrente : qual è la carica in Coulomb consumata dalla lampada in 30 secondi?
soluzione
Carica in Coulomb = corrente x tempo
Carica in Coulomb= 2 A x 30 = 60 Coulomb
4- Calcolare il tempo richiesto per far passare 36000 C (coulomb) in un bagno elettrolitico usando una corrente di 5 A.
Soluzione
poichè
Carica in coulomb = ampere x secondi allora
secondi= Carica in coulomb /Ampere
Secondi = 36000 C / 5 A = 7200 secondi
esendo 1h=60 sec allora 7200 sec = 2 h
5- Quanti elettroni passano attraverso un filo di rame attraversato da una corrente di 10-16 A ?
soluzione
sappiamo che
piochè 1 A trasporta 6,02 x 1023 elettroni e poichè 1 A=1 coulomb/sec
la velocità = 10-16 Coulomb /s / 6,02 x 1023 Coulomb/elettrone = 600 e/sec
6- Una cella galvanica lavora in condizioni di reversibilità alla corrente di 10-16 A :
a) quanto tempo impiega per trasportare 1 mole di elettroni ?
b) quanti elettroni devono essere trasportati dalla cella verso un circuito in 10 millisecondi (ms)?
soluzione
a) secondi = 96500 C / 10-16 C = 9,65 x 1020 sec
b) 10 ms = 10-3 sec / 9,65 x 1020 x 6,02 x 1023 =6 elettroni
7- Un cilindro metallico che pesa 50 g è avvolto con una spira che è una resistenza metallica che lo riscalda per 24 secondi e tra i due estremi vi è una differenza di potenziale di 5,4 Volts. La temperatura iniziale del cilindro è 22,5 °C e dopo riscaldamento diviene 29,8 °C. Se trascuriamo la perdita di calore verso l’esterno calcolare il calore specifico C esprimendolo in Calorie /grammo x °Kelvin
soluzione
L’energia = corrente x volt x tempo pertanto
E= 0,65 A x 5,4 V x 24 sec = 84 Jaule che corrispondono a 84/4,18 = 20 calorie
essendo infine
Energia= massa x calore specifico x differenza di temperatura si ha:
20 cal = 50 x Cspec. x (29,8 -22,5)
da cui Calore specifico = 0,55 cal/g x K
8- Quanti coulomb passano in un’ora attraverso un bagno di elettroplatino che usa una corrente di 5 A .
soluzione
per definizione sappiamo che :
Ampere = coulomb x secondo e che 1 ora= 3600 secondi pertanto:
5 A= 5,0 coulomb x 3600 = 1,8 x 104 Coulomb/ora
L’ ELETTROLISI
Il termine “elettrolisi” è un termine di origine greca e significa “scissione mediante l’elettricità“, infatti sottoporre ad elettrolisi una sostanza significa scomporla negli elementi che la compongono. Le figure mostrano come si scinde l’acqua nei suoi componenti H2 ed O2 e come si scinde il cloruro di sodio fuso


In generale se si sottopone ad elettrolisi un sale i cationi (ioni positivi) si muovono verso il polo negativo (catodo) e gli ioni negativi (anioni) si muovono verso il polo positivo (anodo)
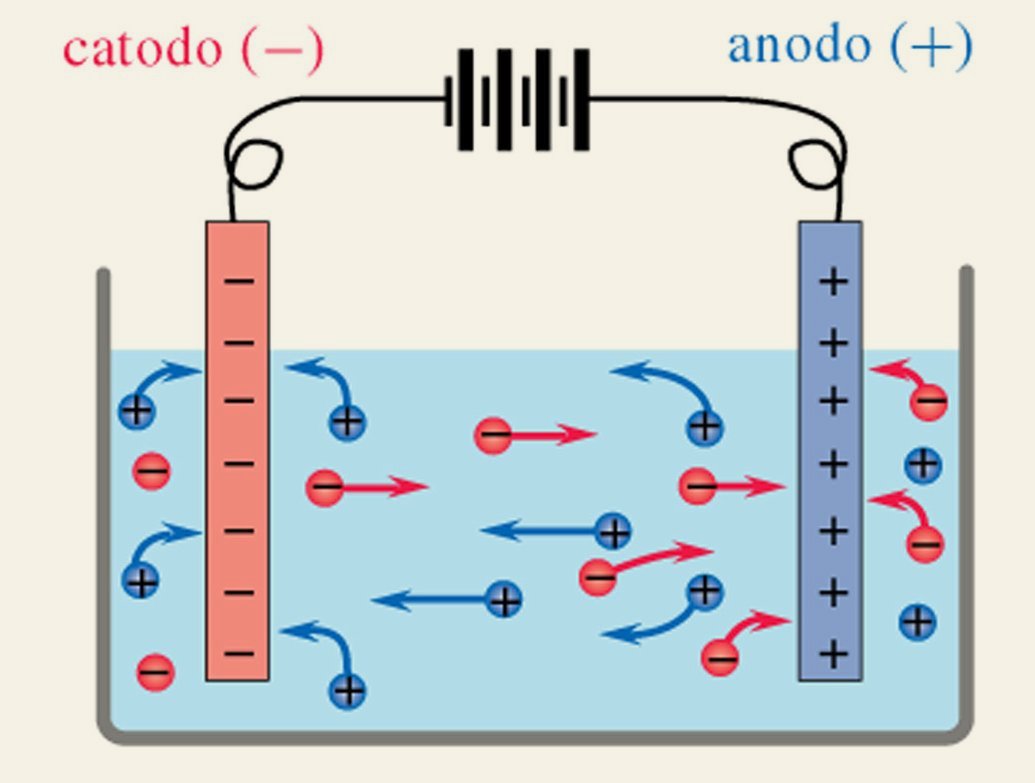
L’elettrolisi è pertanto un metodo che serve per facilitare reazioni non spontanee mediante l’uso di corrente elettrica, infatti le reazioni non spontanee necessitano di energia per poter essere essere realizzate.L’elettrolisi viene usata per ottenere elementi puri dai composti che si trovano in natura come per esempio il rame dai minerali che lo contengono.
Nel circuito esterno alla soluzione, gli elettroni fluiscono dal polo negativo del generatore sino al catodo della cella elettrolitica e dall’anodo di questa al polo positivo del generatore: quindi all’’esterno della cella si ha un continuo flusso di elettroni dall’anodo al catodo. All’interno della soluzione, gli ioni negativi e gli ioni positivi migrano verso gli elettrodi di segno opposto cioè verso il catodo e l’anodo rispettivamente per cui all’interno della cella si ha trasferimento di elettroni dal catodo (che ne è sovraccarico) agli ioni positivi o alle molecole neutre della soluzione,mentre, contemporaneamente vengono trasferiti elettroni all’anodo (che ne è deficitario) dagli ioni negativi o dalle molecole neutre in soluzione.
Questi processi di trasferimento di elettroni che si compiono sulla superficie degli elettrodi rappresentano il momento di transizione tra il trasporto ionico delle cariche elettriche all’interno della soluzione ed il trasporto elettronico attraverso il circuito esterno.
Semireazioni di scarica agli Eleltrodi
Le semireazioni che possono avvenire agli elettrodi sono di tipo diverso a seconda della natura degli elettrodi (inerti o reattivi), e delle specie presenti nella soluzione cioè degli ioni provenienti sia dal soluto che dal solvente e della loro concentrazione.
Quando si chiude ii circuito, al catodo si ha un accumulo dl elettroni e durante l’elettrolisi, avviene la semireazione che tende a rimuovere dall’ elettrodo gli elettroni in eccesso cioè avviene la riduzione degli ioni positivi. Per esempio se vi è un composto A+n B-n in solvente H2O si ha la riduzione catodica
A n+(aq) +ne –> A
2H3O+ + 2e –> H2(g) + H2O(l)
2 H2O(l) + 2 e –> H2() + 2 OH-
All’anodo si ha un difetto dl elettroni e durante l’elettrolisi avviene la semireazione che tende a cedere all’elettrodo un ugual numero dl elettroni che sono stati acquistati dagli ioni positivi e ciò avviene attraverso gli ioni negativi
Nell’esempio del composto dato sopra saranno gli ioni B-n a cedere gli elettroni cioè si ha una ossidazione
B-n –> B + n e
4OH- –> O2 + 2H2O + 4 e
6 H2O –> O2 + 4 H3O+ + 4 e
SE IN UNA SOLUZIONE VI SONO PIU’ SPECIE CHIMICHE
QUALI SPECIE CHIMICHE SI SCARICANO PRIMA E QUALI DOPO ?
per rispondere a questa domanda procediamo con un esempio:
supponiamo che in soluzione vi siano i seguenti ioni a concentrazione unitaria cioè :
[Fe+2] = [Cu+2] = [Br-] =[ Cl-]
cosa avviene se effettuiamo l’elettrolisi e qual è la minima energia elettrica da usare perché avvenga l’elettrolisi? e quale lavoro occorre?
Per rispondere a queste domande dobbiamo ricorrere ai potenziali standard di riduzione dei singoli elementi:
E° Fe+2/Fe = -0,44 V
E° Cu+2/Cu = 0,34 V
E° Br2/2Br- = 1,06 V
E° Cl2/2Cl- = 1,36 V
consideriamo le possibili reazioni (trascurando l’H2O) sono:
ALL’ANODO (+) AL CATODO (-)
2Br- –> Br2 +2 e E=1,06 V Fe+2 +2e –> Fe E°= -0,44 V
2Cl- –> Cl2 + 2 e E°= 1,36 V Cu+2 +2 e –> Cu E°= 0,34 V
In una cella elettrolitica avvengono le reazioni che richiedono la minore differenza di potenziale possibile da applicare per cui nel caso specifico le possibili reazioni sono tra
Br- ed Fe+2 la cui ΔE°= Eanodo – E catodo= 1,06 -(-)0,44 = 1,50 V
Cl- ed Fe+2 la cui ΔE°= Eanodo – E catodo = 1,36 – (-0,44) = 1,80 V
Br- e Cu+2 la cui ΔE°= Eanodo – E catodo =1,06 -0,34 = 0,72 V
Cl- e Cu+2 la cui ΔE°= Eanodo – E catodo = 1,36 – 0,34 = 1,02 V
Il processo che richiede l’applicazione di minor differenza di potenziale è
2Br- –> Br2 +2 e all’ anodo
Cu+2 +2 e –> Cu al catodo
in cui ΔE =0,72 V
il lavoro in Jaule da compiere perché si depositi Cu e si scarichi Br2 è dato da
Lavoro = nF x ΔE
infatti sappiamo che Volt = jaule/ ampere x secondo= Jaule/Coulomb
pertanto Jaule= volt x Coulomb
Poiché abbiamo le concentrazioni di Br- e Cu+2 unitarie e sappiamo che per scaricare 1 equivalente (Patomico/2) occorrono 96500 Coulomb e per una mole (Patomico) occorrono 2 x 96500 allora
Lavoro in Jaule = 2 x 96500 x 0,72 =13,9 x 104 Jaul
Consideriamo come esempio la produzione industriale del rame.
Questa avviene in diverse fasi a partire dal minerale che si chiama calcopirite e che è costituito da FeCuS2 il primo passo è l’arricchimento del minerale, ossia l’eliminazione, dal minerale stesso, della maggior quantità possibile di ferro e zolfo; successivamente, c’è unarrostimento all’aria che ha lo scopo di eliminare una parte dello zolfo come SO2; a questo punto, ciò che resta viene trattato in forno ad alta temperatura in presenza di silice SiO2 e di carbone: in questo modo, la maggior parte del ferro passa nella scoria sotto forma dimetasilicato ferroso FeSiO3, mentre il rame, data la sua elevata affinità con lo zolfo, rimane sotto forma di solfuro rameoso Cu2S; questo solfuro, alla temperatura del forno, si separa dalla scoria fusa più leggera come un liquido nero, pesante, che prende il nome di metallina. La metallina fusa viene allora convertita in rame grezzo(99% circa di rame puro), a 900-1200°C, in un dispositivo nel quale avvengono due diverse reazioni

Durante il processo di raffinazione di rame, le impurezze metalliche del anodo di rame si disciolgono nell’elettrolita e formano un cosiddetto fango anodico. Se l’arsenico, antimonio e bismuto, passano nell’ elettrolita, essi possono subire diverse reazioni, a seconda delle rispettive concentrazioni. L’Arsenico passa come As (III) nell’ elettrolita e in parte viene ossidato in As(V).Ciò può formare arseniati difficilmente solubili con antimonio e bismuto, che possono portare a problemi come intasamento dei tubi o difetti catodici nell’ elettrolisi. In passato, si usavano processi di pulizia a più fasi nelle raffinerie, e sono state utilizzate resine di scambio ionico , ma non hanno avuto successo, perché le resine si saturavano e la rigenerazione era troppo costosa anche se la società Enviolet ha sviluppato un nuovo metodo che evita questi problemi utilizzando esclusivamente la resina Lewatit. Il recupero dell’acido di rigenerazione è un passo significativo per la redditività del processo. Con il metodo Enviolet è possibile riciclare l’80% di acido rigenerante.
ASPETTI QUANTITATIVI DELL’ELETTROLISI
La quantità di sostanza che si deposita su un elettrodo è direttamente proporzionale alla quantità di carica, espressa in Coulomb, che fluisce nella cella elettrolitica.
Quando attraverso una cella elettrolitica fluisce una quantità di carica pari ad 1 Faraday cioè 96500 Coulomb allora si deposita su un elettrodo 1 equivalente di sostanza
[1 Equivalente = peso grammi / (PM /numero elettroni scambiati)].
1 FARADAY = carica di 1 elettrone x mole di elettroni = 1,60 x 10 -19 C x 6,02 x 10 23 = 96500 C/mole
Questo significa che se è nota la quantità di corrente che attraversa la cella allora è possibile calcolare la quantità in grammi di elemento che si deposita all’elettrodo.
ESERCIZI SULL’ ELETTROLISI
1- calcolare quanti grammi di rame (peso atomico= 63,55) e quanti ml di Ossigeno misurato a condizioni normali (273° C e 1 atmosfera) si ottengono sottoponendo ad elettrolisi una soluzione acquosa di CuSO4 per 2 ore con una corrente di intensità pari a 100 mA (milliampere) con un rendimento di corrente pari al 90%.
soluzione
Sappiamo che 96500 Coulomb depositano 1 equivalente di Cu ed 1 equivalente di Ossigeno .
le reazioni che avvengono sono:
Cu+2 → Cu +2 e
2O-2→ O2 +4 e
1 equivalente di Cu è pari a 63,55 /2 =31,77 g
1 equivalente di Ossigeno è pari a 32/4 = 8 g
la quantità di corrente è calcolabile dalla Coulomb = ampere x secondo
quindi essendo 1 ora pari a 3600 secondi allora 2 ore corrispondono a 7200 secondi allora
coulomb= 0,100 ampere x 7200 = 720 Coulomb
pertanto se 96500 C depositano 1 equivalente di Cu pari a 31,77 g allora 720 ne depositeranno X
96500 : 31,77 = 720 :X X= 0,237 g di Cu
96500: 8 = 720 : X X= 0,0597 g
poichè a c.n. 1 mole di una qualunque sostanza occupa un volume di 22,4 litri allora 0,0579 /32 moli occupano un volume X
X= 22,4 x 0,059/32) / 1 =0,0413 litri cioè Volume di O2 = 41,3 ml
2-Quanti Faraday occorrono per l’elettrolisi di una mole di CuCl2 per ottenere Cu e Cl2?
Soluzione
Un equivalente di Cu che è PMCu/2 cioè 1/2 di mole di Cu (che è pari al PM) viene depositato da 1 Faraday quindi per depositare 1 mole di Cu cioè 2 equivalenti occorrono 2 Faraday.
3- una corrente di 10 A viene fatta passare in un bagno elettrolitico di una soluzione di solfato di rame con due elettrodi di Rame.Cosa avviene agli elettrodi?
soluzione
all’anodo si ha : Cu → Cu+2 +2 e
al catodo si ha : Cu+2 + 2 e → Cu
la quantità di corrente è 10 A per 1 ora cioè Coulomb = 10 x 3600 = 36000 Coulomb
se 96500 C depositano 31,77 g (1 equivalente ) di Cu allora 36000 ne depositano X
X= 36000 x 31,77 /96500 = 11,85 g di Cu cioè 0,186 moli di Cu
Pertanto al catodo si ottengono 11,85 g di Rame metallico mentre l’elettrodo di rame che è l’anodo si scioglie nella stessa quantità.
4- Una corrente costante attraversa una soluzione di AuCl4– tra due elettrodi di oro.Dopo 10 minuti il catodo aumenta la propria massa di 1,314 g .Quanta carica elettrica è passata? e quale era la corrente?
soluzione
La reazione che avviene al catodo( polo negativo) è la riduzione di Au+3 ad Au°:
AuCl4– + 3 e → Au° + 4 Cl- quindi la quantità dell’Au al catodo è 1,3134 g cioè
1,314 / 197 = 6,67 x 10-3 moli di Au
Poichè 1 mole di Au+3 richiede una carica di 3 elettroni allora 6,67 x 10-3 moli di Au ne richiedono una quantità X X= 6,67 x 10-3 x 3/1 = 2,00 x 10-2 elettroni
La corrente è I= Ampere= = q/t essendo però t=10 min =600 secondi e q = 96500 x 2,00 x 10-2
I= 2,00 x 10-2 x 96500 /600 = 3,22 A
5- Quanto Cu si deposita dopo aver fatto passare una corrente di 2 A per 482 secondi in una soluzione di CuSO4 2 M ?
soluzione
sappiamo che 1 equivalente di rame (essendo in soluzione come Cu+2 è pari a 63,55/2 g), si deposita quando la soluzione è attraversata da 96500 C.
poichè 1 A = coulomb / sec allora coulomb= A x sec
quindi 2 x 482 = coulomb
quindi se 96500 C depositano 1 equivalente (63,55/2 g) allora 564 Coulomb ne depositano X
X= 564 x 31.78 /96500 =0,185 equivalenti cioè 0,186 x2 = 0.372 g
6- una corrente di 15 A attraversa una soluzione di CrCl2 per 45 minuti.Quanti grammi di Cromo si depositano al catodo e quanti ml di Cl2 si ottengono all’anodo alla pressione di 1 atmosfera e 273°C ( a condizioni normali).
soluzione
sappiamo che 96500 Coulomb depositano 1 equivalente di sostanza che per il Cr+2 è pari a 52/2 g e per il Cloro è 71/2 g .
I coulomb che attraversano la soluzione sono Coulomb = Ampere x sec
Pertanto 45 x 60 = sec e quindi Coulomb = 15 x 45 x 60 = 40500 C
Pertanto, se 96500 coulomb depositano 26 g di Cr (1 equivalente) allora 40500 C ne depositano X X= 40500 x 26 / 96500 = 10,91 g d Cr
se 96500 C depositano 71/2 g di Cl2 gassoso allora 40500 ne depositano X
X = 35,5 x 40500 /96500 = 14,89 g di Cl2
per ottenere il volume ricordiamo che 1 mole di gas a condizioni normali occupa un volume di 22,4 litri quindi 14,89/71 occupano un volume X
1 : 22,4 = 14,89/71 :X X = 4,7 litri
7- calcolare quanto mercurio si deposita al catrodo da una soluzione di Hg(NO3)2 e di una soluzione di Hg2(NO3)2 dopo pasaggio di 19300 Coulomb.
soluzione
sappiamo che 96500 C deposita 1 equivalente di mercurio che nel caso di Hg(NO3)2 è PM/2 cioè 201 /2 = 100,5 g e nel caso di Hg2(NO3)2 è PM/1 =201 g pertanto 19300 C deppositeranno X g
96500 : 100,5 = 19300 : X X= 20,1 g nel caso del Hg(NO3)2
96500 ;201 = 18300 :X X= 40,2 g nel caso di Hg2(NO3)2
8- Calcolare il peso equivalente dello Zn quando una corrente di 5 A fluisce per 30 minuti attraverso una soluzione contenente il metallo e ne deposita al catodo 3,048 g .
soluzione
Coulomb= ampere x sec pertanto
C= 5 x (30 minuti x 60) sec = 5 x 1800 =9000 Coulomb
quindi se 1 equivalente di zinco viene depositato da 96500 C allora X equivalenti saranno depositati da 9000 C
1 eq : 96500 = Xeq : 9000
X= equivalenti di Zn = 9000/96500 =0,093 equiv
essi corrispondono a 3,048 g pertanto essendo equiv = g / PM/valenza cioè equiv= g/Peso equiv
pertanto peso equivalente = g/equiv quindi
Peq Zn= 3,04 /0,093=32,68 g
9- quanto tempo è necessario per depositare 100 g di Al da una soluzione di Al2O3 attraversata da 125 A se riteniamo che l’unico prodotto al catodo sia Al.
soluzione
essendo il Peso equivalente di Al+3 = PAt/3 = 27/3 =9 g allora gli equivalenti ottenuti sono
equiv Al = 100/9 = 11,1 equiv
se 96500 C depositano 1 equivalente X coulomb depositano 11,1 equiv
96500 : 1 = X : 11,1 X = coulomb = 11,1 x 96500 = 10751150 C
Poichè C = Ampere x Sec allora 10751150 = 125 x tempo in sec
pertanto tempo in sec = 10751150 / 125 = 86009,2 sec
cioè essendo 1 h =3600 sec allora 86009,2 sec = 23,89 h
QUI’ INIZIANO GLI ESERCIZI UN PO’ PIU’ DIFFICILI
10- in un accumulatore al piombo il polo positivo costituito da PbO2 (PM= 239,19) si riduce formando PbSO4 (PM=303,25).Calcolare l’aumento di peso del polo positivo dopo erogazione di una corrente pari ad 1 Ampere per 50 ore se il rendimento è del 93%.
soluzione
consideriamo il rendimento al 100% .
la scarica del PbO2 è PbO2 +HSO4- + 2 e + 3H3O+ → PbSO4 +5 H2O
Se 1 mole di PbO2 239,19 g forma una mole di PbSO4 303,25 g
l’aumento di peso è 302,25 – 239,19 = 64,06
Poichè il Pb da n-ossidazione +4 (PbO2) si trasforma in n.o. +2 (PbSO4) l’aumento di peso corrisponde al passaggio di 2 moli di elettroni cioè 2 x 96500 Coulomb = 193000 C
I Coulomb erogati sono calcolati ricordando che
Coulomb = Ampere x Secondo quindi essendo stato erogato 1 A per 50 ore (50 x 3600) ne consegue che Coulomb erogati = 180000
se 2 x 96500 C producono un aumento di 64,06 g 18000 C produrranno un aumento di X g
193000 : 64,06 = 18000 :X X = 59,74 g
Ricordiamo però che il rendimento è del 93%
100:93 =X : 59,74 X= 59,74 x 100 / 93 = 64,23 g
11- attraverso 100 g di soluzione di K2SO4 al 10% viene fatta passare una corrente di 1 A per 29 h 26 m 40″ calcolare l % in peso di K2SO4 alla fine dell’elettrolisi per cui il rendi mento è del 90%.
soluzione
i processi elettrodici di K2SO4 in soluzione sono
6H2O → O2↑ + 4H3O+ + 4e
4H2O + 4e → 2H2↑ + 4OH-
___________________________
10 H2O →2H2↑ +O2 ↑ + 4H3O+ + 4 OH- cioè
10 H2O → 2H2 + O2 + 8H2O pertanto
2H2O → H2 +O2
la specie che si elettrolizza è H2O che si scinde in idrogeno ed ossigeno che essendo gas scompaiono dalla soluzione.
La corrente in coulomb che attraversa la soluzione è
C = A x sec = 1 x 29 h 26 m 40″ (cioè 29 x 3600 + 26 x 60 + 40 secondi) quindi
C = 1 x 107200 =107200
essendo il rendimento della corrente 90% allora i coulomb sono
C= 107200 x 90/100 = 96480
Dalle reazioni agli elettrodi scritte sopra, si nota che sono 4 le moli di elettroni da cui si evince che 4 x 96500 C decompongono 2 moli di H2O , cioè decompongono 2 x 18 g di H2O, quindi 96480 C decomporranno X moli di H2O:
4x 96500 : 2 x 18 = 96480 : X X= 9,0 g H2O
La soluzione iniziale era costituita da 10 g di K2SO4 e 90 g di H2O (era al 10 %) pertanto dopo elettrolisi essendo stati consumati 9 g di H2O il K2SO4 che inizialmente era 10 g si ritrova adesso sempre nella stessa quantità 10 g ma in una quantità di H2O pari a 90-9 = 81 g quindi la percentuale di K2SO4 che si riscontra è calcolata dalla proporzione
se 10 grammi sono contenuti in 81 + 10 = 90 g di soluzione, X saranno contenuti in 100
da cui X= 10 x 100 / 90 = 10,99 %
12- Abbiamo 2 celle elettrolitiche messe in serie: una contenente una soluzione di AgNO3 e l’altra una soluzione di H2SO4 quindi si fa passare una certa quantità di corrente . Si osserva che al catodo della prima cella si depositano 0,2 g di Ag (PA= 107,88) e si desidera conoscere il volume totale dei gas sviluppati nella seconda cella ad una temperatura di 20°C e 750 mmHg.
soluzione
Essendo Ag monovalente, si hanno al catodo 0,2/107,88= 1,584 x 10-3 equivalenti di Ag
si deduce che la corrente attraversata dalla cellula è calcolata dalla proporzione:
se 96500 C depositano 1 equivalente di Ag quanti C depositano 1,85 x 10-3 equivalenti?
96500 : 1 = X : 1,85 x 10-3
X= 96500 x 1,85 x 10-3 /1 = 178,9 Coulomb
Le reazioni che si osservano nella seconda cella contenente H2SO4 sono
6H2O → O2↑ + 4H3O+ + 4e
4H2O + 4e → 2H2↑ + 4OH-
___________________________
10 H2O →2H2↑ +O2 ↑ + 4H3O+ + 4 OH- cioè
10 H2O → 2H2 + O2 + 8H2O pertanto
2H2O → H2↑ +O2 ↑
si osserva che il passaggio di 4 moli di elettroni (4 Faraday cioè 4 x 96500) produce 3 moli di gas quindi se 4 x 96500 C sviluppano 3 moli di gas allora 178,9 C svilupperanno X moli
4 x 96500 : 3 = 178,9 :X
X = 1,39 x 10-3 moli di gas sviluppati nella seconda cella.
Dall’equazione di stato dei gas possiamo calcolare il volume corrispondente a 1,39 x 10-3 moli:
PV= nRT V= nRT/P
quindi V=1,39 x 10-3 x 0,0821 x 293 / 760/750
V= 3,3 x 10-2 Litri
13-due celle elettrolitiche con elettrodi di platino una contenente una soluzione di CuSO4 ( PA Cu= 63,45), l’altra di AgNO3 (PA Ag= 10788) sono collegate in serie ed il catodo di quest’ultima cella pesa 0,1 g in più rispetto al catodo dell’altra cellaa CuSO4.Calcolare quanto tempo necessita affinché i due elettrodi abbiano lo stesso peso se la corrente utilizzata è di 100 mA (milliampere).
soluzione
Il passaggio di 96500 C deposita sul catodo della prima cella 1 equivalente di Cu che è pari al PA/2 cioè 63,45 /2= 31,72 g in quanto si ha la catodo la reazione seguente:
Cu+2 + 2 e → Cu
per l’Ag si ha
Ag+ + e → Ag pertanto 96500 C depositano 107,88 g di Ag
il catodo in cui si deposita Ag rispetto a quello con Cu aumenta di una quantità pari a
107,88 -31,72= 76,16 g
Per ottenere quanta corrente deve attraversare la cella di Ag affinché il peso del catodo sia 0,1 g in più di quello del Cu è calcolabile dalla proporzione:
se 96500 C depositano 76,16 g in più di Cu allora X coulomb depositeranno 0,1 in più cioè: 96500 : 76,16 = X : 0,1 da cui X = 9650,0 /76,16 = 126,7 Coulomb
Sapendo che Coulomb = Ampere x sec allora 126,7 = 0,1 A (cioè 100 mA) x Sec
Sec = 126,7 /0,1 = 1267 secondi cioè essendo 1 minuto pari a 60 secondi si ha
1267 sec= 21minuti e 12 secondi
14- Da una soluzione acquosa contenente ionio Cr+3 e Zn+2 possiamo depositare insieme i due metalli mediante elettrolisi. Dopo passaggio di una corrente media di 1 A con rendimento al 95 % per 1 ora 57 minuti 11 sec il deposito al catodo dei 2 metalli è 1,730 g. Calcolare la composizione percentuale conoscendo il PACr= 52,0 e PAZn = 65,4.
soluzione
1h 57′ e 11″ corrispondono a 3600 + 57×60 + 11 secondi = 7031 secondi quindi
Coulomb= 7031 x 1A x 0,95 ( essendo il rendimento della corrente pari al 95%)= 6680 C
le reazioni al catodo sono : Zn+2 +2 e → Zn e Cr+3 + 3 e → Cr
se indichiamo con X il peso di Zn e con Y il peso di Cr al catodo si depositano
X/(65,4/2) g di Zn e Y/ (52,0/3 )g di Cr che devono esser gli equivalenti totali depositati da 6680/96500= 0,0692 Faraday quindi questa quantità di Faraday deposita
2 x X/65,4 + 3 x Y/52,0 = 0,0692
inoltre X+Y = 1,730 g da cui X= 1,730-Y e sostituendo
(1,739-Y)x 2 / 64,4 + 3 x Y /52,0 = 0,0692
da cui si ottiene X= 0,60 g ed Y= 1,13 g
Le percentuali sono : 1,73 ;0,6 = 100 : x %Zn= 34,7 e %Cr= 65,3
15-In una cella elettrolitica, con elettrodi inerti e a 25,0 oc, le soluzioni catodica ed anodica, separate da un setto poroso, sono ambedue alla stessa concentrazione di KzS04 e hanno ambedue i>l volume di 200,0 cc. Tale cella viene fatta attraversare da una corrente di 30,0 m A per 30 minuti primi. Ammesso un rendimento di corrente del 100%, si calcoli il pH della soluzione catodica e della soluzione anodica dopo il passaggio della corrente.
soluzione
Il K2SO4 non subisce idrolisi, e quindi,prima del passaggio di corrente,la soluzione catodica e quella anodica
sono ambedue a pH=7,00.
La quantità di elettricità (Q) che ha traversato la cella è
Q=0,03A · (30 · 60)s=54,0 C
Semireazione Soluzione catodica :H2O→ ½ H2 + OH-
Pertanto l F (96490 C) produce una mole di ioni OH- ; le moli OH- prodotte da 54 C sono date dalla proporzione
96490: 1=54: x x=5,6 ·10- 4 moli .
Queste sono contenute in 200,0 cc di soluzione, e quindi
[OH-.]=5,6 · 10-4 ·1000/200=2,8. 10-3 M da cui
pOH= 2,55, e quindi essendo pOH+pH = 14 pH = 11,45
.
Semireazione Soluzione anodica 3H2O → ½ O2 +2 e + 2H3O+
Pertanto l F produce l mole di ioni H3O+ ; le moli di H3O+ prodotte da 54,0 C, indicate con y, sono date dalla proporzione
96490: 1=54: y y =5,6 · 10-4 moli
Queste sono contenute in 200,0 cc di soluzione, e quindi
[H3O+] = 5,6. 10-4 x 1000/200 =2,8 . 10– 3 M
pH = 2,55
E’ da notare che a seguito dell’elettrolisi la [OH-] nella zona catodica è numericamente uguale alla [H3O+] nella zona anodica, l’aumento del pH nella zona ·catodica (11,45-7=4,45 unità di pH) è uguale alla diminuzione del pH nella zona anodica (7 -2,55= 4,45 unità di pH).
18 – Dopo 50 minuti di elettrolisi, in una soluzione contenente disciolto un sale di argento, il catodo, di nichel, deUa superficie di 100,0 cm2 è ricoperto da uno strato di Ag (p.a. = 107,88} dello spessore di 10,0 μ
Sappiamo che densità dell’argento è d= 10,5 g/cc, e che il rendimento di correntc è del 90%, si calcoli l’intensità media della corrente durante l’elettrolisi.
soluzione
Per la risoluzione del problema va prima determinata la quantità di argento depositato; da questo dato si calcolano, tenendo conto del rendimento di corrente, i coulomb che hanno traversato la cella durante l’elettrolisi; noto tale numero e la durata dell’elettrolisi, si calcola l’intensità media della corrente.
Volume dell’Ag depositato è 100 cm2 x (10 x 10-4 cm)= 0,1 cm3
la densità dell’Ag è 10,5 g/cc per cui il peso di Ag depositato è 0,1. 10,5= 1,05 g
corrispondente a 1,05/107,88 = 9,7.1 . 10-3 moli
La deposizione di una mole di Ag (Ag++e → Ag) richiede lF (96490 C); pertanto la deposizione di 9,73 · 10-3 moli di Ag richiedono 9,73 . 10-3 x 96490=938,85 C
Poiché il rendimento di corrente nella elettrolisi proposta è del 90 %, i coulomb che realmente passano nella cella durante l’elettrolisi sono
938,85 C x 100 / 90 =1043,2 C
Ricordando che Coulomb = Ampere· l secondo, l’intensità di corrente durante i 50’di elettrolisi C =1043,2/50 x 60 = 0,348A
19- L’acido acetico CH3COOH si può ottenere per ossidazione dell’alcol etilico CH3CH2OH per via chimica oppure elettrochimicamente. Prendendo 1 Kg di soluzione acquosa di alcol etilico al 12 % in peso :
1- calcolare quanti litri di O2 sono necessari per ossidarlo ad acido acetico CH3COOH a condizioni normali
2- calcolare per quanto tempo occorre sottoporre ad idrolisi la soluzione con una corrente di 1 A
soluzione
Essendo la soluzione acquosa al 12 % significa che in 1 Kg di soluzione vi sono 120 g di CH3CH2OH (PM= 46) cioè
Moli alcol = 120/46= 2,61 moli
La reazione di ossidazione chimica è :
CH3CH2OH + O2 →CH3COOH + H2O
infatti il n. o del C legato all’ossigeno è dato dalla somma +1 essendo legato con 1 doppietto all’ossigeno più elettronegativo e -2 essendo legato a 2 atomi di H meno elettronegativi quindi +1 -2= -1
in CH3COOH il C legato all’ossigeno ha n.o. +3 perchè legato con 3 legami (uno doppio ed uno singolo) all’ossigeno più elettronegativo
CH3CH2OH + H2O → CH3COOH + 4e + 4 H+
O2 + 4 e + 4H+ → 2 O-2 + 2H2O
_____________________________
CH3CH2OH + O2 → CH3COOH + H2O
da questa reazione si evince che 1 mole di CH3CH2OH consuma 1 mole di O2 quindi nel caso specifico
2,61 moli di CH3CH2OH consumano 2,61 moli di O2 a cui corrisponde il volume calcolato dall’equazione di stato dei gas:
V = nRT/P = 2,61 moli x 22,414 = 58,5 litri di O2
La semireazione di ossidazione elettrochimica è :
CH3CH2OH + H2O → CH3COOH + 4e + 4 H+
da questa si evince che 1 mole di etanolo coinvolge 4 elettroni quindi 4 x 96500 Coulomb quindi 2,61 moli coinvolgono X Coulomb pertanto
1 : 4 x 96500 = 2,61 :X X = 96500 x 2,61 /4 = 10007460 C = 10,07 x 106 Coulomb
Poichè C=A x sec il tempo in secondi è:
sec = 10,07 x 106 / 1 A = 10,07 x 106 secondi = 10,07 x 106 / 3600 = 280 ore
20-Viene effettuata l’elettrolisi di una soluzione acquosa a 25,0°C, contenente ioni Co+2 e Cd+2 ambedue con concentrazione = 0,010 M: si riducono inizialmente gli ioni Co2+ e sul catodo si deposita cobalto metallico.
Noti i valori E°Co = – 0,28 V c E°Cd =- 0,40V, si calcoli a quale concentrazione degli ioni Co2+ inizia la riduzione degli ioni Cd+2 , con deposizione sul catodo di cadmio metallico.
soluzione
Poiché nei processi catodici (di riduzione) si riduce per prima la specie più ossidante, (con E° più positivo o meno negativo) sono gli ioni Co2+ (E°= -0,28 V) a ridursi prima degli ioni Cd (E°=-0,40V). Il potenziale catodico (E) a cui inizia a depositarsi cadmio, si calcola dall’equazione di Nernst E=E° +RT/nf log [Cd+2] ed essendo [Cd+2]= 0,01 M
E= – 0,40 +0,06 /2 log 0,01 = -0,459 V
Man mano che procede la riduzione degli ioni Co2+ il potenziale E diminuisce perchè diminuisce Co+2 nella soluzione, finché, raggiunto il valore di -0,459V, iniziano a ridursi gli ioni Cd+2.
La concentrazione degli ioni Co2+ quando il potenziale E ha raggiunto il valore di -0,459 si calcola mediante l’equazione di Nemst
E=-0,459 = – 0,28+0,06/2 log [Co+2] da cui [Co+2] = 8,76 x 10-7 M
L’elettrolisi inizia con la riduzione al catodo della specie più ossidante; al procedere dell’elettrolisi la concentrazìonc di tale specie va dininuendo ed allorchè raggiunge il valore cui corrisponde un potenziale uguale a quello di riduzione della specie meno ossidante inizia la riduzione di questa. La riduzione delle due specie è tanto più nettamente separata quanto maggiore è la differenza tra i due potenziali, e al diminuire di tale differenza la separazione diviene meno netta; al limite ,se i potenziali fossero uguali, la riduzione delle due specie sarebbe simultanea, fin dall’inizio dell’elettrolisi. Se le specie riducibili in soluzione fossero più due, quanto detto sarebbe sempre valido.ùà.
21-Un accumulatore al piombo carico, è costituito da una placca positiva e una negativa, immerse in 1,000 kg di soluzione acquosa al 35% in peso di H2SO4; esso eroga una corrente di 1,000 A per 13h 39′ 54″: calcolare il nuovo valore della percentuale in peso di H2SO4 nella soluzione,note le reazioni elettrodiche:
al polo positivo (anodo)
PbO2 + + 2 e + HSO4- + 3H3O+ → PbSO4 + 5H2O (l)
al polo negativo ( anodo)
8 Pb + HS04 + HzO ~ PbS04 + 2e + H30+ (2)
soluzione
La somma delle due reazioni che . rappresenta la reazione globale di scarica, può essere scritta,
PbO2 + Pb + 2H2SO4→ 2PbSO4 + 2H2O
Pertanto al passaggio di 2 Faraday corrisponde alla scomparsa, nella soluzione, di 2 moli H2SO4 (2 x 98,08 g = 196,16 g)
e la formazione di 2 moli H2O (2 x 18,02 g = 36,04 g).
I coulomb erogati dall’accumulatore sono
lA x (13 h• 3600+39min • 60+ 54sec )sec = 49194 C
e le quantità prodotte di H2O e consumate di H2SO4 sono :
2 · 96500(C) : 196,16 g = 49194 : X X= 50 g di H2SO4 consumati
2 · 96500(C) : 36,04 g == 49194 : Y = 9,2 g di H2O prodotti
In 1 kg di soluzione iniziale al 35,0% di H2SO4 , erano contenuti 350,0 g H2SO4 e 650 g H2O; dopo erogazione della corrente sono contenuti
350,0 g- 50,0 g = 300,0 g H2SO4
650,0 g + 9,2 g = 659,2 g H2O
