ENTROPIA
Settembre 18, 2024IL PRIMO PRINCIPIO della termodinamica definisce la relazione tra le varie forme di energia presenti in un sistema, il lavoro che il sistema può eseguire e la quantità di calore che si sviluppa . Il primo principio afferma che l’energia è conservata in tutti i processi termodinamici. C’e tuttavia un problema: in natura alcuni fenomeni avvengono spontaneamente ed altri invece necessitano di un intervento esterno. Per esempio, un corpo freddo a contatto con un corpo caldo si riscalda perché il calore fluisce sempre dal corpo più caldo a quello più freddo sino a che la temperatura tra i due corpi non diviene uguale. Alcune reazioni chimiche avvengono in una sola direzione come ad esempio, la combustione del diamante produce CO2 ma la CO2 non riforma spontaneamente il diamante : esistono, quindi, in natura variazioni spontanee ed altre non spontanee. Ma cosa determina la spontaneità di una variazione in natura? Il primo principio della termodinamica ΔΕ = Q – PΔV ci dice che in un processo l’energia si può trasformare in calore e lavoro ma si conserva. Tuttavia, osserviamo anche che ogni processo tende sempre a raggiungere uno stato di energia più bassa e quindi apparentemente si ha una perdita di energia. Infatti, se l’ energia di un sistema in esame apparentemente diminuisce occorre tener conto che l’ambiente o universo che circonda il sistema aumenta la propria energia della stessa quantità che viene persa dal sistema. Quando in un sistema avviene una variazione, l’energia totale rimane costante ma varia la sua distribuzione ed è proprio la distribuzione che determina la spontaneità di un fenomeno. Si deduce quindi che un processo spontaneo è in realtà una conseguenza del fatto che la tendenza naturale dell’Universo è quella di andare verso il Caos o grande disordine. In un processo spontaneo,l’esempio evidente della distribuzione dell’ energia in diverse forme può essere rappresentato da una pallina che rimbalza su un pavimento.Sappiamo tutti che dopo ogni rimbalzo, l’altezza della pallina diminuisce sempre più a causa dell’attrito tra pallina e pavimento e quindi il processo tende a portare la pallina a rimanere, alla fine, ferma sul pavimento avendo trasformato l’energia cinetica in energia potenziale ed avendo perso energia a causa dell’attrito con l’aria e col pavimento. La direzione del fenomeno è sempre diretta verso lo stato di immobilità della pallina e non si è mai osservato che una pallina ferma si metta a rimbalzare da sola sul pavimento.Abbiamo quindi scoperto che la direzione di un fenomeno spontaneo è quella che porta il sistema alla dispersione caotica dell’energia proprio ciò che avviene alla pallina che rimbalza e che disperde l’energia in un numero di modi termici del pavimento ed è impossibile coordinare l’energia dispersa per far avvenire il fenomeno inverso.
Dobbiamo fare una distinzione tra processi irreversibili e processi reversibili(in questi ultimi gli stati finale ed iniziale differiscono di un infinitesimo per cui è possibile il processo inverso dallo stato finale a quello iniziale. Per esempio consideriamo due gas che si trovano in compartimenti separati ma contigui: sino a che rimangono separati si ha un certo ordine ma se i compartimenti sono messi in comunicazione il disordine aumenta in seguito al miscelamento.

Il primo principio della termodinamica usa l’ ENERGIA INTERNA per identificare processi possibili e quindi abbiamo la necessità di definire un SECONDO PRINCIPIO che ci permetta di stabilire se un processo è spontaneo o meno cioè se un processo è reversibile o irreversibile. Ci chiediamo se esiste un’entità matematica che sia in grado di misurare il grado di disordine di un sistema cioè il grado di dispersione del calore durante un processo. Per individuare questa entità matematica consideriamo un gas che si trova in condizioni isoterme (T=k) ad una pressione P1 e volume V1 che su un grafico Pressione volume indichiamo con A e supponiamo di effettuare una trasformazione reversibile sino a portare i gas dallo stato A ad uno stato B seguendo un percorso che indichiamo con I
P 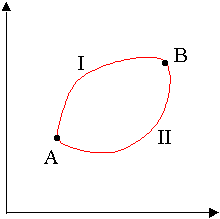
volume
poi da B sempre in modo reversibile ritorniamo allo stato iniziale A tramite il percorso II che è diverso da al percorso I.questo significa che abbiamo effettuato un ciclo reversibile. Lo stato A è caratterizzato da una pressione p_A e volume V_A, (il volume in figura è sull’asse delle ascisse= , lo stato Bi è caratterizzato da una pressione P_B e volume V_B. La linea che congiunge A a B e B ad A non è altro che l’unione di punti che differiscono l’un l’altro di un infinitesimo e per ogni punto cioè in ogni spostamento infinitesimo lungo questa curva si avrà uno scambio di calore che possiamo indicare con dQ. Questo scambio di calore avviene ad una certa temperatura T (dQ sarà positivo se il sistema assorbe calore dall’esterno mentre sarà negativo se cede calore, e se non vi è scambio di calore dQ=0 ). Per arrivare a B partendo da A il calore è dato dalla somma delle quantità dQ per ogni singolo punto sulla curva quindi si può scrivere dQ/T . Tutte queste quantità sommate sono rappresentate da un integrale ciclico che si rappresenta con il segno di integrale con un cerchietto proprio per indicare che la somma è estesa ad un percorso ciclico. Proprio perché si ha un ciclo, si ha:
∮dQ/T =0 per un processo reversibile∮dQ/T <0 per un processo irreversibile
Questo è l’integrale di Clausius. L’integrale di Clausius assume valore pari a zero in un percorso reversibile come nel caso in esame ed è minore di zero in un processo irreversibile.
. Consideriamo allora proprio il ciclo A-B-A con tutte trasformazioni reversibili. L’integrale di Clausius si può scrivere
∮dQ/T = ∫ABdQ/T + ∫BAdQ/T =0 cioè∫ABdQ/T = -∫BAdQ/T cioè∫ABdQ/T = ∫ABdQ/T
questo significa che la quantità Q/T è una quantità che non dipende dal percorso effettuato ma esclusivamente dallo stato iniziale e finale. Ciò comporta che la quantità Q/T è UNA FUNZIONE DI STATO CHE VIENE CHIAMATA ENTROPIA ED INDICATA CON S.
Questo vuol dire che nel caso del ciclo possiamo scrivere
∫A BdQ/T =SB- SA
il che ci permette di scrivere anche:
dS = dq/T
Ricordando che per il primo principio ,in un processo reversibile si ha dE = dq -Pdv dove P=n RT/V e per un processo isotermo dE=0 possiamo scrivere che:
dq=nRT/V e
dq/T = nRdV/V
dS= nRdV/V
Pertanto la variazione di entropia in un processo reversibile è:
dS= nRln V2/V1
NEL PROCESSO REVERSIBILE DESCRITTO SOPRA CON PERCORSO DALLO STATO A ALLO STATO B SI HA:
ΔS = nR ∫dV/V da cui SB – SA = nR ln VB/VA = nR ln VB- lnVA
Esempio
Un campione di idrogeno è contenuto in un cilindro con pistone a stretta tenuta di 50 cm2 ; il volume iniziale a 25°C è 500 ml (0,5 litri) alla pressione di 2 atm. Calcolare la variazione di entropia quando il pistone è isotermicamente spostato di 10 cm.
soluzione
il numero di moli di idrogeno è n= PV/RT = 2 x 0,50 / 0,0821 x 298,15 = 0,041 moli
ΔS =( 0,041 mol x 8,314 j/K ln (1000 ml /500 ml ) = 0,34 J/K mol x ln 2 = 0,24 J/K mol
Consideriamo adesso un sistema ciclico simile a quello descritto sopra ma con un percorso A→ B irreversibile ed uno BA reversibile.
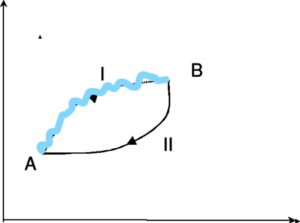
Sappiamo che
∮dQ/T =0 se il processo è reversibile∮dQ/T < 0 se il processo è irreversibile
consideriamo il processo irreversibile
∮dQ/T < o quindi se consideriamo il ciclo completo A-B-A∮ dQ/T = ∫AB dQ/T irr + ∫BAdQ/T rev < 0
portando l’integrale
∫BAdQ/T al secondo membro cambia di segno e quindi possiamo scrivere ∫ABdQ/T rev = SB – SA > ∫ABdQ/T irrev
ΔS = SA – SB >
∫ABdQ/T irr
Consideriamo adesso il sistema in esame (un cerchio) circondato dal suo ambiente : il tutto costituisce un Universo che in questo caso è isolato cioè non scambia nè energia nè materia con l’ambiente esterno all’Universo considerato:
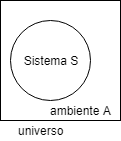
l’universo di cui parliamo non è da intendere come l’Universo cosmologicamente ma semplicemente come l’insieme del sistema e dell’ambiente che lo circonda.Ciò ci serve a comprendere il significato della diseguaglianza
ΔS = SA – SB >
∫ABdQ/T irrev
andiamo a calcolare la variazione del’entropia dell’Universo in considerazione che sarà ΔS>
∫univdQ/T
irrev
tuttavia l’universo è isolato quindi dQ =0 pertanto
∫univdQ/T =0
ΔSuniv = ΔS sistema + ΔS ambiente > 0
Quindi in un sistema generico è sempre valida la disuguaglianza scritta sopra. Tuttavia nel caso in cui come sistema si ha una macchina termica che funziona su un percorso ciclico, in questo caso essendo l’entropia una funzione di stato la variazione di entropia del sistema
ΔS sistema = 0
il che significa che nel caso in cui si verifica un processo irreversibile l’entropia dell’ambiente è
ΔS ambiente > 0
quindi l’entropia dell’universo aumenta.
VARIAZIONE DI ENTROPIA CON LA TEMPERATURA, PRESSIONE ,IL VOLUME E LO STATO FISICO
In un processo reversibile, in relazione al primo principio della termodinamica si ha : dQ=dE + PdV e sappiamo anche che dQ=TdS per cui TdS = dE+ PdV ma H= E+PV per cui differenziando si ha
dH dE+ PdV + VdP pertanto possiamo scrivere TdS = dH -VdP
VARIAZIONE DI ENTROPIA CON LA TEMPERATURA
in un processo reversibile a volume costante essendo dQ=dE + PdV ed essendo dV=0 si ha dQ=dE =TdS
Sappiamo inoltre che dE= Cv dt quindi TdS = CvdT quindi
dS= CvdT/T
per una variazione finita a volume costante la variazione di entropia è:
∫12dS = S2-S1 = ∆S = ∫T1T2Cv dt/T
cioè
∆S= Cv ln T2/T1
in un processo reversibile a pressione costante
dH= TdS
essendo dP=0 per cui
dH= Cp dT
TdS= CpdT
dS= Cp dT/T
da cui per una variazione finita si ha
∫12dS = S2 – S1 =∆S = ∫T1T2Cp dT/T∆S = ∫T1T2 dT/T = Cp lnT2/T1e per n moli di sostanza ∆S= ST2-ST1=n Cp lnT2/T1
in assenza di transizioni di fase.
Se Cp dipende dalla temperatura secondo la relazione CP= a + bT +cT2
allora si ha
∆S =∫T1T2 (a+ bT+ cT2)dT/T ∆S =∫T1T2 (a/T+ b+ cT)dT∆S = alnT2/T1 +b( T2-T1) + C/2 (T22 – T21)
In una REAZIONE CHIMICA
ΔS reaz=∑ Sprodotti – ∑Sreagenti
l’effetto della temperatura sull’entropia di una reazione chimica è:
ricordando che dH= CpdT
d(ΔH)= ΔCpdT
ma dQ= Td(ΔS) = d(ΔH)
Td(ΔS) = ΔCpdT
dove ΔH = variazione di entalpia della reazione e ΔCp la variazione termica a P=K associata alla reazione.
Per una variazione finita si ha :
∫12d(∆S) = ∆ST2- ∆ST1 = ∫T1T2 ∆Cp dT/Tse tra T1 e T2 Cp è costante si può scrivere∆ST2- ∆ST1 = ∆Cp ∫T1T2 dT/T∆ST2- ∆ST1 = ∆Cp lnT2/T1
VARIAZIONE DI ENTROPIA CON LA PRESSIONE
Dalla relazione
TdS = dH – VdP
essendo
dH =CpdT
TdS= CpdT- VdP
dS = Cp dT/T -V/TdP
ma per un gas perfetto si ha PV= nRT perciò per 1 mole V/T = R/P quindi
dS = Cp dT/T – R dP/P
in una trasformazione isoterma si ha dS= -RdP/P ed integrando tra P1 e P2
ΔS= S2 -S1= -R lnP2/P1 e per n moli
ΔS= S2 -S1= – nR lnP2/P1
e se integriamo ds=-RdP/P tra lo stato standard e la pressione P si ha
S – S° = -RlnP S= S° -RlnP
VARIAZIONE DI ENTROPIA IN FUNZIONE DELLA TEMPERATURA E DELLA PRESSIONE
dS= Cp dT/T – R dP/P
integrando si ha
∆S = ∫T1T2 CpdT/T – R lnP2/P1 ∆S = Cp ln T2/T1 – RlnP2/P1 se Cp è costante tra T1 e T2
VARIAZIONE DI ENTROPIA CON IL VOLUME
TdS = dE + PdV
ma dE= CvdT
TdS= CvdT + PdV
dS= CvdT/T + P/T dV
ma PV=nRT
P/T =R/V e sostituendo
dS= CvdT/T +RdV/V
e per un processo isotermo
dS=R dV/V
ΔS = S2-S1 = RlnV2/V1
la variazione di entropia con la temperatura e col volume, è
dS= Cv dT/T +R dV/V
integrando se Cv = k si ha
ΔS = Cv lnT2/T1 + RlnV2/V1
VARIAZIONE DI ENTROPIA IN FUNZIONE DELLO STATO FISICO
supponiamo che vi sia una trasformazione reversibile e che decorra a P=K ed alla temperatura di equilibrio allora
dS=dQ rev / T
dS=dH / T
ΔS= ΔH / T
