LE REAZIONI CHIMICHE PARTE 1 :COME FARLE SENZA IMPARARLE A MEMORIA
Settembre 14, 2024Una reazione chimica è un processo in cui alcune specie chimiche, dette reagenti, interagiscono tra loro trasformandosi in
specie chimiche diverse dette prodotti. es
A + B ——> C + D
Reagenti Prodotti
possiamo avere tipi di reazione diversi ad es
1)Reazioni di sintesi
2)Reazioni di decomposizione
3)Reazioni di scambio semplice
4)Reazioni di scambio doppio
1) Reazioni di sintesi: A + B → C
Sono quelle reazioni chimiche nelle quali duediversi reagenti (A e B) formano un unico prodotto (C). Un esempio di reazione di sintesi è quella tra carbonio e ossigeno con formazione di anidride carbonica:
C(s) + O2(g) → CO2(g)
la lettera g indica che il composto si trova allo stato gassoso
2) Reazioni di decomposizione: A → B
A → B + C
Sono quelle reazioni chimiche nelle quali un unico reagente (A) si decompone in due prodotti (B e C).La decomposizione alle alte temperature del carbonato di calcio (CaCO3) è un esempio di questo tipo di reazioni:
CaCO3(s) → CaO(s) + CO2(g)
3) Reazioni di scambio semplice :
A + BC → AC + B
Sono quelle reazioni chimiche nelle quali un elemento libero (A) sostituisce e prende il posto di un elemento (Bpresente nel composto (BC)
Un esempio è la reazione tra sodio metallico ed acqua con sviluppo di idrogeno:
2 Na (s) + 2 H2O (l) → 2 NaOH (aq) + H2(g)
4) Reazioni di doppio scambio:
AB + CD → AD + CB
Sono quelle reazioni chimiche nelle quali due composti (AB e CD) si scambiano i “partner”. Un esempio è la reazione tra nitrato di piombo Pb(NO3)2 e ioduro di potassio KI con formazione di un precipitatogiallo di PbI2
:
Pb(NO3)2 (aq) + 2 KI (aq) → PbI2(s) + 2 KNO3(aq)
aq vuole indicare che il composto si trova in soluzione acquosa
Prima di cominciare ripassiamo alcuni concetti di base:
COSA SONO GLI ATOMI E DA COSA SONO COSTITUITI
L’atomo è la struttura più semplice con cui la materia (solida liquida gas) è organizzata.
Se un insieme di atomi è costituito da strutture dello stesso tipo ogni atomo costituisce un elemento chimico.
STRUTTURA DELL’ATOMO
L’atomo è costituito da
1– un NUCLEO (COSTITUITO DA PROTONI E NEUTRONI)in cui risiede la maggior parte della massa
IL NUCLEO HA CARICA POSITIVA DOVUTA AI PROTONI ( I NEUTRONI NON HANNO CARICA PER QUESTO SONO ELETTRICAMENTE NEUTRI CIOE’ CON CARICA NULLA)
2- ELETTRONI con CARICA NEGATIVA che si muovono intorno al nucleo molto velocemente e non occupano posizioni fisse definitive.
le cariche positive del nucleo in un atomo sono in quantità uguali al numero di elettroni che si muovono intorno ad esso QUINDI UN ATOMO E’ SEMPRE ELETTRICAMENTE NEUTRO.
Se un atomo presenta uno o più elettroni in meno (cioè perde una o più cariche negative si forma uno IONE POSITIVO con tante cariche positive quanti sono gli elettroni mancanti (CATIONE)
Se un atomo presenta uno o più elettroni in più (cioè se possiede una o più cariche negative si forma uno IONE NEGATIVO con cariche negative pari al numero di elettroni in più (ANIONE)
Esempio
l’IDROGENO il cui simbolo è H (dalla parola greca Hydroghenion cioè generatore di acqua) è l’atomo più semplice che conosciamo
infatti possiede un PROTONE ed un elettrone.
NOTA : se uno stesso atomo possiede neutroni oltre ai protoni, gli atomi con neutroni si definiscono ISOTOPI DI QUELL’ATOMO)
Ad esempio l’idrogeno in natura è costituito da 3 ISOTOPI
IDROGENO con 1 protone e senza neutroni
DEUTERIO con 1 protone e 1 neutrone ( IN QUESTO CASO LA MASSA È QUELLA DI UN PROTONE + UN NEUTRONE)
TRITIO con 1 protone e 2 neutroni ( IN QUESTO CASO LA MASSA È QUELLA DI UN PROTONE + DUE NEUTRONI)
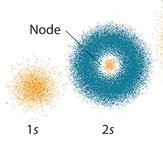
l’atomo di H quindi possiede un elettrone che spende la maggior parte del suo tempo in una zona, intorno al nucleo, di densità sferica e questa posizione dipende dalla sua energia quindi possiamo dire che spende la maggior parte del tempo in una zona sferica che indichiamo pertanto come ZONA ORBITALE 1 S o più semplicemente ORBITALE 1S IN QUANTO 1 è IL PRIMO LIVELLO DI ENERGIA DELL’ELETTRONE
Se facciamo in modo di aumentare l’energia dell’elettrone esso si sposterà in una zona successiva a quella 1 S e poiché anche questa zona ha densità sferica, ovviamente più grande rispetto all’1S, si definisce livello energetico 2S
se aumentiamo poco poco di più l’energia vediamo che l’elettrone si muoverà in zone di densità non più sferiche ma che possono avere la direzione dei tre assi cartesiani ed in questo caso le tre zone possiedono energia uguale (e sono per questo detti orbitali degeneri)
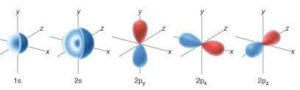
IL NOME DI QUESTI ORBITALI È 2Px 2Py 2Pz (2pz è quello verticale) la cui forma puoi vedere nella figura
Aumentando ancora l’energia dell’elettrone vediamo che si muove sempre in una zona di tipo S cioè 3S che come nella figura ed è più grande del 2S.
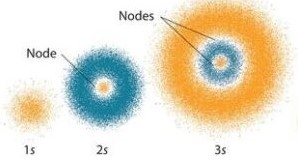
Naturalmente siccome in un atomo le zone S sono concentriche, tra un orbitale S e quello successivo vi è il vuoto (si chiama zona nodale) dove l’elettrone non può trovarsi.(nella foto degli orbitali S puoi vedere che i nodi si trovano tra il nucleo e l’orbitale 1S, tra 1S e 2S e tra 2S e 3S)
Aumentando ancora di poco avremo zone di tipo P cioè 3P la cui forma è identica a quella dei 2 P della foto sopra e sono diretti sempre secondo gli assi cartesiani x,y,z, (3Px 3Py 3Pz )
Questa volta se aumentiamo l’energia avremo le zone orbitali 3d che sono 5
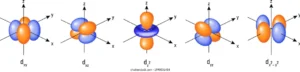
Gli atomi pertanto possiedono elettroni che si possono muovere negli orbitali 1S 2S 2Px 2Py 2Pz , 3S 3P ed i 5 orbitali 3d
Ulteriore energia fornisce gli orbitali 4S 4Px 4Py 4Pz e 5 orbitali 4d ed infine 7 orbitali f (che quì non descriviamo)
Tutti gli atomi possiedono questi livelli elettronici e differiscono tra loro solo per il numero di elettroni
(fai finta che tutti gli atomi abbiano la stessa casa ma che è il numero di abitanti (elettroni) che li individuano)
Se vi sono atomi con più elettroni sappi che essi occupano gli orbitali seguendo alcune regole :
In ogni orbitale possono esserci 2 soli elettroni ( principio di esclusione di Pauli) e se vi sono orbitali con uguale energia (2P 3P e 3d) allora gli elettroni tendono ad occuparli uno per ogni orbitale e poi a due alla volta (principio della massima molteplicità di Hund).
Facciamo alcuni esempi semplici
l’idrogeno H ha 1 solo elettrone che occupa l’orbitale 1 S e ciò si indica con 1S1 (gli elettroni si indicano come esponente)
l’ elio ha 2 elettroni e per il principio di pauli occupano ambedue l’orbitale 1S quindi l’elio He si può scrivere 1S2
quindi se troviamo scritta una struttura di un atomo come 1S1 sappiamo che si tratta dell’idrogeno il cui simbolo è H
se troviamo scritta una struttura di un atomo come 1S2 sappiamo che si tratta dell’ elio simbolo He
il litio ha 3 elettroni quindi la sua struttura deve essere 1S2 2S1
Il berillio ha 4 elettroni e quindi la sua struttura deve essere 1S2 2S2 il simbolo è Be
Il boro ha 5 elettroni e quindi la sua struttura deve essere 1S2 2S2 2P1 il simbolo è B
il Carbonio ha 6 elettroni quindi la sua struttura atomica è 1S2 2S2 2Px1 2Py1 simbolo C (ricorda il principio della massima molteplicità di Hund)
l’azoto simbolo N possiede 7 elettroni quindi la struttura è 1S2 2S2 2Px1 2Py1 2Pz1
l’ossigeno simbolo O ha 8 elettroni quindi si può rappresentare con la struttura 1sS2 2S2 2Px2 2Py1 2Pz1
(come vedi una volta occupati singolarmente i 3 orbitali P si cominciano ad occupare gli stessi orbitali con due elettroni)
il Fluoro simbolo F ha 9 elettroni quindi possiamo scrivere 1S2 2S2 2Px2 2Py2 2Pz1
il Neon simbolo Ne possiede 10 elettroni quindi la struttura è 1S2 2S2 2Px2 Py2 2Pz2
il sodio simbolo Na ha 11 elettroni quindi la struttura è 1S2 2S2 2Px2 2Py2 2Pz2 3S1
A questo punto voglio farti osservare che H Li ed Na possiedono le seguenti strutture:
H 1S1
Li 1S2 2S1
Na 1S2 2S2 2Px2 2Py2 2Pz2 3S1
come vedi, tutti e tre hanno una cosa in comune: possiedono nel livello più esterno, che è di tipo S, un solo elettrone e quindi essi devono reagire allo stesso modo perché la reattività degli elementi dipende dalla struttura elettronica del livello più esterno.
Per esempio con l’ossigeno formano
H2O Li2O Na2O
Ma ti puoi chiedere perché con l’ossigeno non si può formare ad esempi H3O o H5O ed anche ad esempio Li4O ecc?
semplice la risposta
abbiamo detto che la reattività dipende dalla struttura esterna di un atomo ed infatti quando si trovano a contatto gli atomi tendono sempre e comunque a formare in un orbitale un doppietto elettronico
l’Ossigeno è 1S2 2S2 2Px1 2Py1
l’idrogeno è 1S1
come vedi 1S1 dell’idrogeno si accoppia con 1Px1 dell’Ossigeno ma la reazione è incompleta perché anche 2Py1 dell’ossigeno si deve accoppiare se ha l’idrogeno a contatto
quindi 1S2 2S2 2Px1 2Py1
l’idrogeno è 1S1
altro idrogeno 1S1
pertanto si ha la formazione di H2O e solo di H2O perchè idrogeno ed ossigeno non possiedono altri elettroni non accoppiati
Prendiamo ad esempio l’azoto 1S2 2S2 2Px1 2Py1 2Pz1
se lo facciamo reagire con l’H 1S1 1S1 1S1 1S1
H H H
come vedi si può formare solo NH3 perchè sono 3 gli elettroni non accoppiati dell’azoto di azoto N
alla fine si formerà una struttura con tutti gli elettroni accoppiati.
Adesso ti pongo una domanda: se all’idrogeno H 1S1 tolgo l’elettrone che succede? Ti ricordi? si forma H+ perchè abbiamo tolto dall’atomo neutro un elettrone quindi abbiamo ottenuto il catione H+ che è il nucleo dell’idrogeno cioè il PROTONE infatti H+ è chiamato protone
Se al sodio togliamo l’elettrone esterno si ha la struttura 1S2 2S2 2Px2 2Py2 2Pz2
ovviamente avendo tolto un elettrone si forma Na+ quindi lo ione sodio Na+ ha la struttura 1S2 2S2 2Px2 2Py2 2Pz2
che differisce dall’atomo che era 1S2 2S2 2Px2 2Py2 2Pz2 3S1
PRIMA DI PROCEDERE DOBBIAMO FARE UN’ALTRA CONSIDERAZIONE.
Tutti gli elementi chimici sono stati raggruppati secondo il numero di massa crescente (protoni +neutroni) in una tavola chiamata di Mendelayev dal nome del primo autore e che oggi ha la seguente forma:

gli elementi della prima colonna (primo gruppo detto gruppo IA) possiedono tutti una struttura con elettrone spaiato in un orbitale S e formano ioni con carica +1 (es. H+ Li+ Na+ K+ Cs+) o per meglio dire numero di ossidazione +1 ( vedremo in seguito cosa significhi numero di ossidazione).
gli elementi della seconda colonna(gruppo IIA) possiedono numero di ossidazione +2
es Ca+2 Mg+2 Ba+2
se ci spostiamo sulla destra della tavola vediamo che vi è il gruppo III A
gli elementi gruppo III A possiedono un numero di ossidazione dispari compresi tra 0 e 3
per es. Al +1 oppure Al+3
se ci spostiamo nel gruppo IV A gli atomi possiedono un numero di ossidazione pari compreso tra 0 e 4
es. C+2 C+4
Sn+2 Sn+4 (Sn è lo stagno)
Pb+2 Pb+4 (Pb è il piombo)
Si+2 Si+4 (Si è il silicio)
gli elementi gruppo V A possiedono un numero di ossidazione dispari compresi tra 0 e 5
es N+1 N+3 N+5 (l’azoto può anche avere numero di ossidazione negativo (- 3)
P+1 P+3 P+5 (fosforo)
As +1 As+3 As+5 (arsenico)
Sb +1 Sb+3 Sb+5 (antimonio il simbolo Sb deriva dal latino Stibium)
Bi+1 Bi+3 Bi+5 (bismuto)
se ci spostiamo nel gruppo VI A gli atomi possiedono un numero di ossidazione pari compreso tra -2 0 e 6
ATTENZIONE ! in questo gruppo fa eccezione l’ossigeno O
che ha sempre un numero di ossidazione negativo!!! cioè -2
lo zolfo simbolo S ha numeri di ossidazione S-2 S0 S+2 S+4 S+6
COME CONOSCERE IL NUMERO DI OSSIDAZIONE IN UN COMPOSTO
SENZA DIFFICOLTA’
Dobbiamo sapere che i composti possono essere costituiti da 2 atomi (uguali o diversi).In questo caso il composto è detto BINARIO
Se i composti sono costituiti da 3 atomi diversi il composto si dice TERNARIO.
Se i due atomi in un composto binario sono uguali ad es O2 N2 S8 essi formano una MOLECOLA dell’elemento (nell’esempio una molecola di ossigeno, azoto,zolfo)
Se tra i due atomi vi è l’ossigeno ad es K2O CaO Na2O P2O5 SO2 NO2 il composto è chiamato OSSIDO DELL’ELEMENTO
(nell’esempio Ossido di Potassio ossido, di Calcio,Ossido di sodio Pentossido( dal greco penta perchè vi sono 5 atomi di O )di Fosforo, Biossido (vi sono 2 atomi di O) di zolfo, Biossido di azoto.
Per esempio H2O secondo le regole internazionali deve essere chiamata OSSIDO DI DIIDROGENO ( vi sono 2 atomi di H) ma si preferisce indicarla col nome semplice ACQUA
Se nella molecola sono presenti uno o più OH il composto è chiamato IDROSSIDO (il gruppo OH è trattato come se fosse un elemento unico)(considerato che il gruppo OH che si forma
es Ca(OH)2 Al(OH)3 Mg(OH)2 idrossido di Calcio, idrossido di alluminio idrossido di magnesio
(secondo la regole internazionali dovremmo chiamarli DIIDROSSICALCIO TRIIDROSSIALLUMINIO E DIIDROSSIMAGNESIO)
NOTA:
1-gli idrossidi possono essere formati dalla reazione tra Ossidi di elementi cosiddetti alcalini es K,Na.Li, Ca, Mg ed H2O e per questo gli OSSIDI sono definiti BASICI considerato che il gruppo OH- che si forma è definito BASE.
2 – Invece, dalla reaz:;ione tra Ossidi di elementi non alcalini es P S N ed H2O si ottengono composti detti ACIDI es H3PO4 H2SO4 HNO3 (Es H2O + SO3 —- H2SO4)
Negli altri casi il nome del composto binario finisce sempre in -URO ed è elettricamente sempre neutro
NaCl CLOR-URO DI SODIO
BaCl2 CLORURO DI BARIO
LiI IODURO DI LITIO
KF FLUORURO DI POTASSIO
NEI COMPOSTI BINARI IL PRIMO ELEMENTO HA SEMPRE NUMERO DI OSSIDAZIONE POSITIVO ED E’ DATO DALLA QUANTITA’ DI ATOMI DEL SECONDO ELEMENTO
IL SECONDO ELEMENTO HA SEMPRE NUMERO DI OSSIDAZIONE (N.O) NEGATIVO ED E’ DATO DALLA QUANTITA’ DI ATOMI DEL PRIMO ELEMENTO
ESEMPIO
IL N.O. DEL CALCIO IN CaCl2 è + 2 ( vi sono 2 atomi di cloro) quindi nel composto si ha Ca+2 ed ogni atomo di Cl ha N.O. -1 cioè Cl-1
infatti nella molecola il calcio è presente con un solo atomo.
pertanto in CaCl2 si ha Ca+2 e 2 Cl-1
SI DEDUCE CHE PUOI CONOSCERE IMMEDIATAMENTE IL N.O. DI OGNI ATOMO IN UN COMPOSTO BINARIO
ESEMPIO 1
DIRE IL N. O. DEL GRUPPO OH NEL COMPOSTO Ba(OH)2
risposta
ricordando che il gruppo OH è come se fosse un solo elemento il suo N.O. corrisponde alla quantità di atomi di Bario che è 1
QUINDI IL N-O- DEL GRUPPO OH è OH-1 ( in questa molecola vi sono 2 gruppi OH-1 )
Il N.O. DEL BARIO E’ +2 IN QUANTO VI SONO 2 GRUPPI OH LEGATI QUINDI Ba+2
ESEMPIO 2
DIRE IL N.O. DEL FOSFORO E DELL’OSSIGENO NEL PENTOSSIDO DI DIFOSFORO (P2O5)
risposta
IL n.o. del P in P2O5 è + 5 (vi sono 5 atomi di ossigeno ) P+5
il n. o dell’ossigeno è -2 (vi sono 2 atomi di P ) O-2
esempio 3
DIRE IL N. O. DIEL MAGNESIO E DELL’OSSIGENO NEL COMPOSTO MgO
risposta
in questa molecola ci verrebbe da dire O-1 e Mg -1 ma ATTENZIONE!
RICORDIAMOCI CHE L’OSSIGENEO HA SEMPRE N.O. -2 QUINDI IL Mg DEVE NECESSARIAMENTE AVERE N.O. +2
INFATTI SI DOVREBBE SCRIVERE Mg2O2 MA QUANDO VI SONO NUMERI UGUALI A DESTRA ED A SINISTRA SI SEMPLIFICA COME IN MATEMATICA E NE DERIVA LA FORMULA MgO
PASSIAMO A CALCOLARE IL N.O. DI UN ELEMENTO IN UN COMPOSTO TERNARIO
UN COMPOSTO TERNARIO È COSTITUITO DA 3 ATOMI E SPESSISSIMO IL TERZO ATOMO È L’OSSIGENO
es H2SO4 H2SO3 H2SO2 HNO3 HNO2 H3PO4 H2PO3 HClO3 HClO2 HClO
quando il composto ternario ha come primo elemento un H il composto si definisce ACIDO
in questi composti conosciamo bene il n.o. dell’ossigeno che è sempre 2 (-2) e quello dell’H (sempre +1)
per ottenere il n.o. dell’atomo centrale nel composto ternario acido basta
MOLTIPLICARE X 2 IL NUMERO DI ATOMI DI OSSIGENO
SOTTRARRE IL NUMERO DEgli atomi di H
esempi
H2SO4 n.o. dello zolfo S in questo composto è 2 (valore del n.o. ossigeno eliminando la carica negativa) x 4 atomi di ossigeno =8
sottraiamo il n. di atomi di H (in questo caso 2 ) ed avremo 8-2 =6
in H2SO4 il n.o. dello zolfo è S+6
H2SO3 in questo caso si ha 3 (atomi di ossigeno ) x 2 (valore della carica di ossigeno senza il segno) = 6
sottraiamo 2 (atomi di H ) si ha 6-2 =4
in H2SO3 il n.o. dello zolfo è S+4
H2SO2 in tal caso si ha 2 x 2 = 4 meno 2 (atomi di H) = 4-2=2
in H2SO2 il n.o. dello zolfo è S+2
Sappiamo infatti che lo S può avere n.o. pari da -2 a +6 cioè -2 0 +2 +4 +6
NEGLI ACIDI VISTI SOPRA, IL NOME DIPENDE SEMPRE DAL N,O. DELL’ATOMO CENTRALE
infatti quando il n.o. è massimo il nome finisce in ICO es H2SO4 ACIDO SOLFO-RICO
se il n.o. è appena più basso del massimo il nome finisce in OSO es H2SO3 ACIDO SOLFOR-OSO
se il n.o. è più basso dell’Oso allora il nome
è IPO ( che significa più basso) SOLFOR-OSO es H2SO2 ACIDO IPO-SOLFOR-OSO
LO ZOLFO PUO’ AVERE N.O. -2 IN QUEI COMPOSTI CHIAMATI SOLFURI CIOÈ COMPOSTI BINARI IN CUI LO S È IL SECONDO ELEMENTO
es Na2S K2S CaS
H2S (ACIDO SOLF-IDRICO CIOÈ CON DESINENZA IDRICO IN QUANTO VI È SOLO L’IDR-OGENO LEGATO ALLO S da non confondere con l’acido solforico!!!)
Nell’acido HNO3 l’azoto N ha n.o. 3 x 2 = 6 -1 =5 quindi N+5
l’ acido HNO3 è quindi chiamato ACIDO NITR-ICO
nell’acido HNO2 l’azoto N ha n.o. 2 x 2 = 4 -1= 3 quindi N+3
L’acido HNO2 è chiamato ACIDO NITR-OSO
in H3PO4 il P ha n.o. 4 x 2 = 8 – 3 = 5 quindi P+5
NOTA IMPORTANTE !
UN ELEMENTO CHIMICO ALLO STATO ELEMENTARE ES ZOLFO ELEMENTARE S HA SEMPRE N.O. PARI A ZERO
ES S n.o.=0 Co (COBALTO) N.O. =0 Mg N.O =0 ECC.
SIAMO IN GRADO ADESSO DI FARE LE REAZIONI CHIMICHE
IN CHIMICA LE REAZIONI AVVENGONO PREVALENTEMENTE IN UN SOLVENTE CHE COMUNEMENTE E’ H2O.
L’ACQUA HA LA FORZA PER SCINDERE LA MAGGIOR PARTE DEI COMPOSTI CHE HANNO CARICHE (POLARI) ESSENDO ESSO STESSO UN COMPOSTO POLARE,
Ovviamente in un recipiente contenente acqua le molecole sono attratte l’un l’altra mediante il legame idrogeno
Le molecole di H2O, essendo polari,cioè possedendo una densità di carica negativa sull’ossigeno e positiva sull’idrogeno, se vengono a contatto con composti dotati anch’essi di carica, come ad es.NaCl staccano le particelle positive (Na+) attraendole con la parte dell’ossigeno che, come abbiamo visto, ha carica negativa, e contemporaneamente staccano le particelle negative (Cl-) con la parte dell’idrogeno che è positivo .
Una volta staccate le particelle vengono circondate da altre molecole di acqua formando una sfera al centro della quale si trova uno ione (positivo Na+ o negativo Cl- ,
Il filmato seguente ti mostra ciò che succede quando un cristallo di NaCl viene a contatto con l’acqua. (ovviamente si scioglie).
