Giochi della Chimica 2024 Fase nazionale ‒ Classe B
Novembre 30, 20241. Nella titolazione di un acido forte con una base forte, qual è l’indicatore più adatto da utilizzare, tenendo conto
dei rispettivi intervalli di pH di viraggio, affinché il punto di viraggio sia più vicino al punto equivalente?
A) metilarancio (3,1–4,4)
B) timolftaleina (8,3–10,5)
C) rosso di metile (4,8–6,0)
D) blu di bromotimolo (6,0–7,6)
1. Soluzione
SOLUZIONE
COSA SONO GLI INDICATORI ?
Un indicatore acido base è un acido debole che generalmente si indica con HIn che assume un colore quando si trova allo stato indissociato ed un colore diverso quando si trova nello stato dissociato. Essendo un acido debole si dissocia secondo la reazione
HIn(aq)+H2O(l)⇌H3O+(aq)+In−(aq)
rosso giallo
questa reazione essendo un equilibrio ha una costante di equilibrio cioè una costante di dissociazione che viene indicata come costante dell’indicatore Kind
K ind =⌈ H3O+⌉(aq)+⌈In−⌉(aq) / ⌈HIn⌉(aq)+⌈H2O⌉(l)
K ind =⌈ H3O+⌉(aq) x giallo / rosso x ⌈H2O⌉(l)
⌈ H3O+⌉(aq) = Kind B /A
indicando con A il colore giallo e con B il colore rosso.
Sapendo che l’occhio umano riesce a distinguere il colore A da quello B quando A è 10 volte B
si vedrà il colore giallo A quando questi è 1o volte il rosso B quindi (indicando per comodità ⌈ H3O+⌉(aq) con ⌈H+⌉ possiamo scrivere
⌈H+⌉ = Kind B /10 B e viceversa si vedrà a quando B è 10 A ⌈H+⌉ = Kind 10 A/ A
⌈H+⌉ = Kind 1 /10 e ⌈H+⌉ = Kind x 10
passando ai logaritmi si ha log ⌈H+⌉ = log Kind 1 /10 e ⌈H+⌉ = log Kind – log 10 log ⌈H+⌉ = log Kind + log 10
cambiando di segno avremo le due espressioni che indicano i PH essendo -log =P
– log ⌈H+⌉ = – log Kind -(-log 10) – log ⌈H+⌉ = -log Kind – log 10
PH= PKind + 1 PH= PKind – 1
pertanto la variazione di colore di un indicatore si ha in un intervallo di 2 unità di PH
la titolazione di un acido forte con una base forte ha il punto di equivalenza a pH 7, ed il pH passa immediatamente da valori acidi a valori basici (da pH 4,5 a pH 9,5) con una sola goccia di titolante. Il viraggio dell’indicatore diventa visibile quando si supera il limite superiore dell’intervallo di viraggio, quindi per la titolazione acido forte base forte il limite superiore dell’intervallo di viraggio che è più vicino a 7 lo possiede il blu di bromotimolo ( pH 7,6) Questo indicatore è quello da usare per valutare nel modo migliore il punto equivalente della reazione .
In generale si usano gli indicatori che hanno un Pkind vicino al PH del punto di equivalenza
| nome convenzionale | colore della forma acida | colore della forma basica | intervallo di viraggio |
|---|---|---|---|
| violetto di metile | lilla | viola | 0,1 – 1,5 |
| viola basico 3 | giallo | verde | 0,0 – 0,8 |
| verde | blu | 0,8 – 1,8 | |
| blu | blu-viola | 1,8 – 2,6 | |
| blu di timolo | giallo | blu | 1,2 – 2,8 |
| giallo metile | rosso | giallo | 2,9 – 4,0 |
| metilarancio | rosso | giallo | 3,1 – 4,4 |
| blu di bromofenolo | giallo | blu | 3,0 – 4,6 |
| verde di bromocresolo | giallo | blu | 3,8 – 5,4 |
| rosso metile | rosso | giallo | 4,2 – 6,2 |
| blu di bromotimolo | giallo | blu | 6,0 – 7,6 |
| rosso fenolo | giallo | rosso | 6,4 – 8,0 |
| rosso cresolo | giallo | rosso | 7,2 – 8,8 |
| 1-naftolftaleina | rosa | verde | 7,3 – 8,7 |
| fenolftaleina | incolore | rosso cremisi | 8,0 – 9,9 |
| timolftaleina | incolore | blu | 9,3 – 10,5 |
| violetto bromocresolo | giallo | violetto | 5,2 – 6,8 |
| trinitrotoluene | incolore | arancio | 11,5 – 13,0 |
da notare che esistono anche indicatori REDOX utilizzati per valutare il punto equivalente in una titolazione che utilizza un’ossidoriduzione. e che cambia colore a seconda del valore del potenziale elettrochimico del punto equivalente della reazione.
Risposta corretta D
2. Due isotopi NON hanno lo stesso:
A) numero di protoni
B) numero di massa
C) numero atomico
D) numero di posizione nel sistema periodico degli elementi
2. Soluzione
gli isotopi sono atomi di uno stesso elemento che possiedono lo stesso numero di protoni ma diverso numero di neutroni
IL NUMERO DI MASSA È DATO DALLA SOMMA DEL NUMERO DI PROTONI E DEI NEUTRONI
L’IDROGENO H CHE PRENDIAMO COME ESEMPIO HA DUE ISOTOPI IL DEUTERIO ED IL TRITIO
es H,D, T cioè IDROGENO, DEUTERIO, E TRITIO
L’ IDROGENO H possiede 1 protone soltanto ed ha numero di massa 1 e si indica con 1H
IL DEUTERIO possiede 1 protone ed un neutrone quindi ha numero di massa 2 e si indica con D oppure 2H
il TRITIO possiede 1 protone e 2 neutroni e si indica con T oppure 3H
IL NUMERO ATOMICO INVECE E’ DATO DAL NUMERO DI PROTONI
QUINDI GLI ISOTOPI DELL’IDROGENO VISTI SOPRA,CHE POSSIEDONO LO STESSO NUMERO DI PROTONI POSSIEDONO NUMERO ATOMICO MA NUMERO DI MASSA DIFFERENTE
IL NUMERO DI MASSA SI SCRIVE A SINISTRA IN ALTO DEL SIMBOLO DELL’ELEMENTO ES 238U 235U 12C 14 C
Risposta corretta B
3. In quali delle seguenti sostanze il legame tra gli atomi è di natura prevalentemente ionica?
A) acido cloridrico
B) bromuro di potassio
C) diamante
D) ammoniaca
3. Soluzione
Il legame chimico è un’attrazione di grande forza tra due o più atomi .Le interazioni hanno sempre natura elettrica nel senso che si verificano tra una carica (o densità di carica) con la corrispondente carica o densità di carica di segno opposto.
Esistono tipi di legame chimico che variano con tra due estremi: il legame covalente puro e il legame ionico puro.
Cariche con uguale valore assoluto ma di segno diverso si attraggono con una forza espressa dalla legge di Coulomb:
F = Ğ κ ⋅ q + x q – / r 2
Se consideriamo un atomo A che perde un elettrone, assumerà perciò una carica POSITIVA e viene chiamato CATIONE
Se consideriamo un atomo B che acquista un elettrone, assumerà perciò una carica NEGATIVA e viene chiamato ANIONE
Supponiamo di avvicinare i due ioni, un catione ed un anione : essi si attraggono per la legge di Coulomb ma oltre un certo punto non si possono avvicinare perchè esiste una forza di repulsione tra i nuclei dei due ioni. Questa forza non segue la legge di Coulomb ma è regolata dalla legge
F = B / rn
dove sia B che n dipendono dagli ioni in esame ( n può variare da 5 a 13)
la forza di repulsione a brevi distanze è più grande della forza di attrazione che è proporzionale a 1 / r 2 . La distanza r 0 alla quale le due forze avranno lo stesso valore è la distanza di legame.
Abbiamo visto che gli ioni con cariche di segno opposto si attraggono, ma ci chiediamo in virtù di quali caratteristiche di ogni ione si ha l’attrazione?
La caratteristica più importante in questo caso è l’elettronegatività di un atomo.
L’elettronegatività è la proprietà di un atomo di attrarre gli elettroni di un legame e dipende dall’energia di ionizzazione Eion e dall’ affinità elettronica Eaff
Esistono diverse scale di elettronegatività
1 scala di Pauling
2 scala di Mulliken
3 scala di Allred-Rochow
4 scala di Sanderson
5 scala di Allen
ognuna di esse si fonda su dati diversi che quì però non indichiamo.
Indipendentemente dalla scala prescelta, i valori di elettronegatività mostrano un andamento abbastanza regolare lungo la tavola periodica degli elementi. L’elettronegatività è quindi una proprietà periodica .
I valori di elettronegatività aumentano procedendo da sinistra a destra lungo un periodo, come esemplificato dai seguenti dati
| Elemento | Pauling | Mulliken | Allred-Rochow |
|---|---|---|---|
| Li | 0,98 | 0,97 | 0,97 |
| Be | 1,57 | 1,54 | 1,47 |
| B | 2,04 | 2,04 | 2,01 |
| C | 2,55 | 2,63 | 2,50 |
| N | 3,04 | 2,33 | 3,07 |
| O | 3,44 | 3,17 | 3,50 |
| F | 3,98 | 3,91 | 4,10 |
I valori di elettronegatività inoltre calano procedendo dall’alto verso il basso lungo un gruppo, come illustrato dai seguenti dati relativi agli alogeni
| Elemento | Pauling | Mulliken | Allred-Rochow |
|---|---|---|---|
| F | 3,98 | 3,91 | 4,10 |
| Cl | 3,16 | 3,00 | 2,83 |
| Br | 2,96 | 2,74 | 2,74 |
| I | 2,66 | 2,21 | 2,21 |
adesso possiamo affrontare il quesito proposto.
il potassio ha un’elettronegatività( secondo Pauling ) pari a 0,82 ed il bromo 2,96 quindi tra questi due atomi si instaura pertanto un legame ionico.
l’HCl (allo stato gassoso) forma un legame covalente polare in quanto gli elettroni di legame sono attratti dalla sua elettronegatività maggiore rispetto all’idrogeno (Ricorda che in soluzione invece HCl esiste come H3O+ e Cl–)
Il diamante invece è costituito da atomi di Carbonio soltanto mentre l’ammoniaca NH3 è costituita da Azoto che forma legami covalenti con l’idrogeno
da quanto esposto, la risposta corretta + B
4. Il numero quantico di spin può assumere valori:
A) –n, +n B) –ℓ, +ℓ C) –1/2, +1/2 D) –1, +1
4. Soluzione
Il numero quantico di spin di un elettrone può assumere solo 2 valori +1/2 e –1/2
l’energia di un elettrone si calcola dall’equazione di Schrödinger
EΨ= H Ψ
perchè E sia diverso da zero è necessario che alcuni numeri presenti nella funzione Ψ abbiano valori ben determinati ed in relazione tra loro infatti
n= numero quantico principale, che definisce il livello energetico in cui si trova l’elettrone, può assumere valori che vanno da 1 ad ∝
l = numero quantico quantico secondario, definisce la forma dell’orbitale in cui è collocato l’elettrone. Questo numero quantico è anche noto come numero quantico azimutale o numero quantico rotazionale o numero quantico angolare.
I valori di l vanno da 0 a n -1.
Il numero quantico magnetico, m, ci dice come l’orbitale è orientato nello spazio.
m assume valori interi, anche negativi, compresi tra +l 0 -l
se l=0
m=o per cui si ha uno stato s
se l=1
m= +1,0,-1 (si hanno gli orbitali P che sono 3 )
se l= 2 m= +2,+1.ì,-1,-2 ( si hanno gli orbitali d che sono 5 )
se 2 elettroni si trovano nello stesso orbitale devono avere spin diversi (+1/2 e -1/2 )
la risposta corretta è C
5. Il bilanciamento di una reazione chimica è imposto dalla legge di:
A) Proust B) Lavoisier C) Dalton D) Gay-Lussac
5. Soluzione
legge di proust
La legge di Proust, o legge delle proporzioni definite:
quando due elementi reagiscono tra loro per formare un composto, il rapporto fra le loro masse è sempre costante.
es la reazione tra H ed O forma sempre un composto con rapporti 2:1
legge di lavoisier
la massa dei prodotti di una reazione deve corrispondere alla massa dei reagenti
per esempio 2H2 +O2 → 2 H2O
la massa di acqua ottenuta è pari a 2 x 18 (peso di H2O)= 36 che è uguale alla somma delle masse dei reagenti
(4 x 1,008)+ 2 x 16 = 4 + 32 = 36
la legge di Dalton o legge delle proporzioni multiple
quando due elementi si combinano tra loro dando origine a composti diversi, questi sono sempre in preciso rapporto di combinazione ben definito e costante.
Es FeO ed Fe2 O3
Legge di Gay-Lussac
è una delle leggi che riguardano i Gas e dice che :
a volume costante, la pressione di una massa di gas è direttamente proporzionale alla temperatura assoluta del gas stesso
P/T = K
Nota dello scrivente:
non si comprende perché (ad esclusione della legge di Lavoisier) si continuino ad insegnare leggi obsolete che confondono i ragazzi visto che viviamo in un periodo in cui in chimica tutto ci è chiaro se si studiano i legami chimici mediante teorie più moderne e chiare e soprattutto la stechiometria .
la risposta corretta è B
6. Fra le seguenti molecole H2S, CO2, HCN, NH3, indicare quella la cui struttura di Lewis ha un’unica coppia di
elettroni di non legame sull’atomo centrale.
A) CO2 B) HCN C) NH3 D) H2S
6. Soluzione
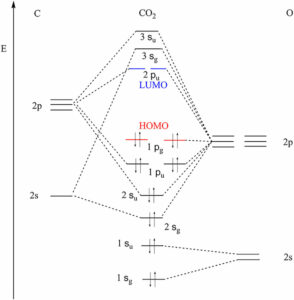
in questo grafico a Sx vi sono gli orbitali del C ed a destra gli orbitali dei 2 atomi di ossigeno.
Puoi notare che nella CO2 (livelli energetici centrali) il C forma 2 orbitali sigma e due π e non vi sono elettroni di non legame.
In realtà se guardiamo CO2 secondo la teoria di Lewis notiamo che i 4 elettroni esterni del C formano 4 legami con l’Ossigeno e quindi non ha coppie elettroniche di non legame.
In H2S
In questo caso la struttura elettronica di S è 1S2 2S2 2PX2 2Py2 2pz2 3s2 3p2x 3p1y 3pz1
i 4 elettroni 3S2 e 3Px formano due coppie di non legame
HCN è simile a CO2 cioè senza elettroni di non legame
In NH3 l’azoto che ha struttura 1s2 2s2 2px1 2py1 2pz1 forma 3 legami con l’idrogeno ma rimane una coppia di non legame 2s2
risposta corretta C
7. La molecola BCl3:
A) ha tre legami dativi B) è poco polare C) è fortemente polare D) ha momento dipolare nullo
7. Soluzione
il legame covalente dativo ( legame di coordinazione). tra due atomi è un legame covalente in cui i due elettroni del legame vengono fornit(dati)i da uno solo degli atomi . Per esempio
Nell’acido clorico HClO3 l’atomo di cloro (Cl) mette in comune due coppie di elettroni (4 elettroni di valenza) a due atomi di ossigeno (O) per formare due legami dativi.
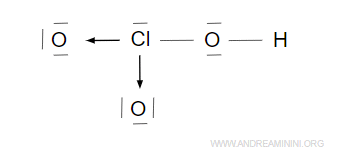
I due legami dativi a sinistra e in basso completano l’ottetto nei primi due atomi di ossigeno.
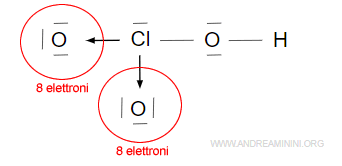
Il terzo legame covalente semplice a destra completa l’ottetto nell’atomo di ossigeno legato con il l’atomo di idrogeno che, invece, completa il duetto.
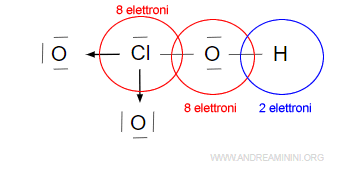
il legame dativo non lo si può distinguere dal legame covalente perché ha le stesse proprietà. L’unica differenza rispetto al legame covalente è nella coppia di elettroni fornita da un solo atomo invece che da due.
La molecola BCl3 è planare trigonale
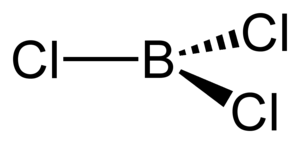
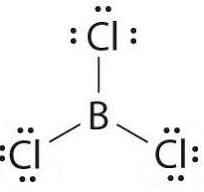
Il legame tra B e Cl è polare ma a causa della struttura i momenti di dipolo dei singoli legami B-Cl si annullano perchè i vettori hanno uguale modulo e giacciono tutti sullo stesso piano.
Risposta corretta D
8. Se si raddoppia la pressione e si triplica la temperatura di un gas ideale, il suo volume diviene:
A) 3/2 di quello originale B) 1/2 di quello originale C) 2/3 di quello originale D) 6 volte quello originale
8. Soluzione
la risposta a questa domanda riguarda l’equazione generale di stato dei gas ideali PV= nRT
da questa deriva V = nRT/P
quindi se P = 3P e T = 3T abbiamo
V1 = nRT1/P1
V2 = nR(3T1)/2P1
V2= 3/2 (nRT1/P1) ma nRT1/P1=V1quindi
V2= 3/2 V1
Risposta corretta A
9. Nella teoria cinetico-molecolare:
A) le particelle in un gas si muovono in maniera casuale e disordinata
B) le particelle in un solido sono libere di muoversi in modo indipendente l’una dall’altra
C) l’energia cinetica media delle particelle in un gas diminuisce con l’aumentare della temperatura
D) nessuna delle altre opzioni è corretta
9. Soluzione
la teoria cinetica dei gas descrive un gas come un gran numero di piccole particelle che sono in costante movimento casuale. Le particelle muovendosi urtano tra di loro e con le pareti del contenitore. La teoria cinetica dei gas spiega le principali proprietà dei gas quali Pressione Temperatura e Volume.
la relazione matematica che lega la temperatura all’energia cinetica è :
1/2 x m x 3RT/M dove m= massa M= peso Molecolare
da cui si ottiene
K = 3RT/2Na
K= 3/2 Kb T dove Kb = costante di Boltzman = 1,38 x 10-23Joule/K
da questa espressione si vede che l’energia cinetica media delle particelle è direttamente proporzionale a T
Più aumenta T, maggiore sarà la velocità delle molecole e quindi maggiore sarà il numero di urti elastici tra le molecole-
Risposta corretta A
10. La variazione di entalpia di una reazione chimica:
A) è sempre negativa
B) è sempre positiva
C) è la differenza tra l’entalpia dei prodotti e l’entalpia dei reagenti
D) è indipendente dalla temperatura
10. Soluzione
il primo principio della termodinamica dice che E = Q + L
dove Q rappresenta l’energia sotto forma di calore ed L l’energia sotto forma di lavoro (lavoro fisico= Forza x spostamento)
Ne caso dei gas si può operare a pressione costante(TRASFORMAZIONE ISOBARA ) o volume costante (TRASFORMAZIONE ISOCORA)
In un gas la forza F che si esercita non è altro che la pressione P e lo spostamento è la variazione di volume ( ΔV) causata dalla forza P quindi
E = Q + PΔV
Per convenzione si è stabilito di assegnare al calore (Q) segno positivo se dall’ambiente fluisce al sistema e negativo se dal sistema va all’ambiente.
Al lavoro (L) si attribuisce segno positivo se è il sistema a compierlo sull’ambiente e segno negativo nel caso contrario.
per convenzionePΔV assume segno positivo se il lavoro è compiuto dal sistema verso l’ambiente esterno mentre è negativo se il lavoro è compiuto sul sistema
A volume costante ΔV=0 per cui E=Q
ciò significa che se forniamo energia sotto forma di calore dall’esterno, tutto il calore fornito serve a far aumentare l’energia interna del sistema
se invece lavoriamo a P=K avremo i volumi V1 iniziale e V2 finale del nostro sistema
non solo ma la trasformazione possiamo farla procedere in modo REVERSIBILE O IRREVERSIBILE
OPERANDO IN MODO IRREVERSIBILE
in condizioni di irreversibilità (ad esempio un’espansione del gas contro una pressione esterna) P nella formula data sopra CORRISPONDE ALLA PRESSIONE ESTERNA AL GAS
Q= ΔE+ P(V2-V1) Q=ΔE+ (PV2 -PV1)
Q= E2-E1 + PV2 – PV1
Q= (E2+ PV2 ) – (E1+PV1) ed indicando la somma
(E2+ PV2 ) = H2 in cui H2 = entalpia allo stato finale 2
(E1+PV1) =H1 in cui H1 = entalpia allo stato iniziale 1
pertanto si ottiene la relazione
H2-H1 =Q ΔH = Q
(Misuriamo la variazione di entalpiai in J mol-1 o kJ mol-1).
questa espressione ci dice che se un sistema passa dallo stato 1 allo stato 2, a pressione costante, la quantità di calore rappresenta la differenza del contenuto termico tra lo stato A ed uno B
Ogni molecola possiede un contenuto termico a P=K dato dall’ ENTALPIA H quindi in una reazione chimica
A + B → C + D
Ha + Hb → Hc +Hd
possiamo scrivere quindi
∑ Hprodotti – ∑ H reagenti =Q a P=k irr
L’Entalpia è una misura di come il calore viene rilasciato o assorbito da un sistema
se in una reazione A→B
si ha A→B +Q cioè viene rilasciato calore la reazione è detta ESOTERMICA
si ha A→B – Q cioè viene assorbito calore la reazione è detta ENDOTERMICA
IN UNA TRASFORMAZIONE ISOBARA REVERSIBILE
P= PRESSIONE DEL GAS
E= Q+ P δV
essendo P la pressione del gas allora dall’espressione PV=nRT e considerando n=1 si ha P= RT/V da cui
E= Q + RT δV/v
E= Q + RT ∫δv/v
tra quantità di calore Q e temperatura esiste la relazione
q = m c ΔT
- q è l’energia trasferita, in joule (J).
- m è la massa in grammi (g).
- c è la capacità termica specifica espressa in joule per Kelvin o joule per gradi Celsius (J K-1 o J ºC-1).
per un gas ideale
ΔH = CpΔT
cp= calore specifico a pressione costante (calore necessario per aumentare di 1 grado la temperatura T di 1 grammo di sostanza)
Si deduce che la differenza di entalpia in una reazione è dipendente in modo diretto dalla temperatura.
IN UNA REAZIONE ESOTERMICA aumentando la temperatura la reazione procede verso sinistra
esempio nella reazione
A + B → C + D + Q
dobbiamo considerare la quantità di calore Q come se si trattasse di un composto per cui se Q aumenta (per effetto dell’aumento della tremperatura) viene favorita la reazione inversa cioè i prodotti riformano i reagenti
nella reazione
A + B → C + D – Q
cioè in una reazione ENDOTERMICA
l’aumento di temperatura favorisce la reazione diretta cioè si formano più prodotti
si deduce quindi che la risposta corretta è C
11. Quale delle seguenti molecole ha le forze intermolecolari più deboli?
A) H2O (acqua) B) NH3 (ammoniaca) C) HF (acido fluoridrico) D) CH4 (metano)
11. Soluzione
Questo tipo di forze nasce fra molecole in cui il baricentro delle cariche negative non coincide con il baricentro delle cariche positive. Ciò è dovuto al fatto che alcune molecole presentano un momento dipolare risultante non nullo, e si comportano dunque come dei deboli dipoli elettrici.
Le forze intermolecolari sono forze che si esercitano fra molecole e/o ioni: sono generalmente molto meno intense delle forze di legame intramolecolari (per intenderci i legami chimici tra atomi che li tengono uniti quando formano una molecola), ma determinano una serie di importanti proprietà macroscopiche della materia.
Le forze intermolecolari contribuiscono a determinare alcune caratteristiche fisiche delle sostanze : allo stato liquido(e ancora di più allo stato solido) queste interazioni sono più forti e causano dunque una maggior compattezza della sostanza, insieme ad una minore mobilità delle molecole.
Un’elevata forza fra le molecole di una soluzione (ad esempio un legame ad idrogeno, come nel caso dell’acqua) ne fa innalzare il punto di ebollizione perché occorre maggior energia per rompere questi legami. Lo stesso discorso si può fare per il punto di fusione.
Nei gas, queste forze sono molto meno meno importanti che nei liquidi o nei solidi, perché l’energia l’energia cinetica delle molecole molecole di un gas è di gran lunga maggiore dell’energia coinvolta nelle interazioni intermolecolari.
Le forze intermolecolari sono:
FORZE IONE-DIPOLO
Sono generalmente le forze intermolecolari più intense. Uno ione positivo (negativo) interagisce con una molecola polare venendo attratto dal polo negativo (positivo) del dipolo.
Un tipico esempio è l’idratazione degli ioni in soluzione acquosa (solvatazione).
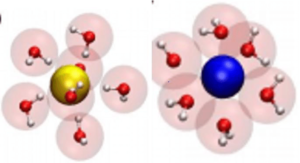
L’acqua è una molecola polare e come tale interagisce con gli ioni. Uno ione positivo ( nella figura colorato in blu) verrà circondato da un certo numero di molecole di acqua orientate con l’atomo di ossigeno (sul quale è localizzata una frazione di carica negativa) verso lo ione;
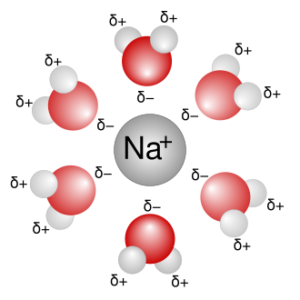
analogamente, uno ione negativo verrà circondato circondato da molecole molecole di acqua orientate con gli atomi di idrogeno (su cui è localizzata una frazione di carica positiva) verso lo ione.
FORZE DIPOLO-DIPOLO
Dati due dipoli elettrici, l’estremità positiva di un dipolo : viene attratta dall’estremità negativa dell’altro e viceversa.
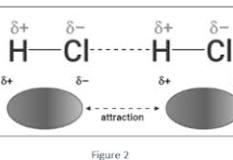
quando sono interessati gli atomi di idrogeno l’interazione viene definita legame idrogeno
FORZE DI VAN DER WAALS
sono un insieme di interazioni intermolecolari che comprende le forze di London e le interazioni dipolo dipolo .
Le FORZE DI LONDON sono il tipo di interazione intermolecolare più debole e si manifestano a causa dello spostamento temporaneo delle cariche che formano la nuvola elettronica di una molecola. Questo fa sì che le forze di London si generino anche fra molecole apolari, dato che negli atomi (o molecole) in cui la distribuzione di carica è mediamente simmetrica, essa non lo è nel momento in cui si avvicina una carica anche parziale. Conseguentemente si origina una molecola dotata istantaneamente di una debole carica elettrica, ossia un dipolo istantaneo, il quale fa nascere un campo elettrico che influenza e polarizza per induzione gli atomi circostanti, detti quindi dipoli indotti. L’effetto a catena che si crea genera legami momentanei fra gli atomi,
Nel caso in esame, HF è una molecola polare e forma legami idrogeno così come l’acqua.
NH3 è polare a causa del doppietto elettronico libero per cui N attira gli elettroni dei legami con l’idrogeno
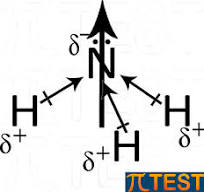
CH4 è un composto apolare per cui nei legami si possono creare solo momenti di dipolo istantanei (forze di London)
ne consegue che la risposta corretta è D
12. Indicare l’affermazione corretta.
A) l’entropia è una misura dell’energia totale di un sistema
B) l’entropia è una funzione di stato
C) l’entropia di un sistema diminuisce quando aumenta il disordine delle particelle
D) l’entropia standard di formazione di un elemento puro è sempre zero
12. Soluzione
Il primo principio della termodinamica E = Q+ L ci permette di stabilire se una reazione produce o meno calore e ci dice se può creare lavoro o meno. Non ci permette però di prevedere se la reazione procede spontaneamente verso la formazione di prodotti o meno. Per questo è stata introdotta una nuova funzione matematica chiamata ENTROPIA
S = Q/T
DURANTE UNA TRASFORMAZIONE SPONTANEA IL DISORDINE DELL’AMBIENTE AUMENTA quindi per stabilire se una trasformazione possa o no avvenire spontaneamente DOBBIAMO CERCARE DI MISURARE IL GRADO DI DISORDINE che essa porta all’intero universo e cioè sia al sistema che all’ambiente.
Sappiamo inoltre che l’ entropia (S) è proporzionale al numero di modi diversi W in cui si possono disporre le particelle del sistema per cui si ha
S = k lnW
• La variazione di disordine che avviene nell’ambiente è una conseguenza della trasformazione del sistema da noi considerato cioè dalla reazione in esame
• Possiamo cercare quindi di mettere in relazione la variazione del disordine dell’ambiente con la variazione di funzioni di stato del sistema o meglio della reazione.
• Il ruolo dell’ambiente, durante una trasformazione, è quello di fornire o sottrarre Calore al sistema, fungendo da enorme “pozzo” di calore, così grande che la sua temperatura rimane costante, anche se il suo disordine varia mediante la cessione o l’acquisto di calore.
• La variazione del disordine dell’ambiente è quindi direttamente proporzionale alla quantità di Calore trasferita al o dal sistema.
• Anche la temperatura dell’ambiente prima del trasferimento di calore verso o da esso influenza il disordine dell’ambiente.
Possiamo dire che la variazione di disordine dell’ambiente è direttamente proporzionale a una variazione opposta di calore del sistema e inversamente proporzionale alla temperatura dell’ambiente che possiamo considerare costante.
Quindi possiamo descrivere la variazione del disordine dell’ambiente in funzione della variazione di entalpia del sistema e della temperatura.
ΔS = ΔH / T
– Questa equazione ci dice che è possibile calcolare la variazione totale di disordine dell’universo avendo informazioni dal solo sistema-
quindi possiamo scrivere che
Δdisord sistema = = ∆H – T∆S
Δdisord sistema
può essere definito come l’energia disponibile da parte del sistema di produrre lavoro infatti T∆S è la parte non disponibile
Questa energia è definita ENERGIA LIBERA di GIBBS
∆G = ∆H – T∆S
Abbiamo visto che per la seconda legge le trasformazioni spontanee avvengono se aumenta il disordine dell’universo il che equivale a dire, se diminuisce l’ordine dell’universo stesso: poiché con G indichiamo l’ordine dell’universo,
una trasformazione avverrà spontaneamente se la G diminuisce e quindi se:
∆G < 0
• Questo succederà se il sistema aumenta il proprio disordine (∆S > 0) o se si ha una diminuzione dell’entalpia del sistema
(∆H < 0) che comporta un aumento del disordine dell’ambiente.
Quando ∆G = 0 il sistema è in equilibrio
se ∆G > 0
la trasformazione non avverrà in modo spontaneo.
Ne consegue che essendo l’entropia una funzione di stato, corrispondente al grado di disordine del sistema, misura la utilizzabilità della sua energia per produrre lavoro infatti si può ottenere energia solo se l’entropia del sistema aumenta.
Risposta corretta B
13. Il pH di una soluzione acquosa di KOH 0,001 mol/L è:
A) 11 B) 9 C) 8 D) 3
13. Soluzione
trattandosi di una base forte la concentrazione di OH- corrisponde alla concentrazione analitica cioè 0,001 quindi
⌈OH-⌉= 10 -3 M
dobbiamo quindi calcolare prima il POH poi il PH pOH = -log ⌈OH-⌉= – log 10-3
quindi POH = 3 e poichè POH+ PH = 14 allora pH = 14 – 3
Risposta corretta A
14-Indicare i grammi di calcio contenuti in 15,00 g di calcare al 57,2% m/m di CaCO3 .
A) 12,00 g
B) 6,86 g
C) 3,43 g
D) 13,70
soluzione
in una molecola di CaCO3 (100 g) vi è un atomo di Ca (40 g) in 15 g ve ne sono X
X= 15 x 40 / 100 = 6 g
Siccome però il calcare non è al 100% bensì al 57,2 %
se in 100 in realtà ve ne sono 5, in 6 ve ne sono X
X= 57,2 x 6 /100 = 3,43 g
Risposta corretta C
15. Data la reazione (da bilanciare): MgO + H3PO4 → Mg3(PO4)2 + H2O
Indicare i grammi di MgO (MM = 40,3 g/mol) e le moli di H3PO4 (MM = 97,99 g/mol) che bisogna fare reagire
per ottenere 26,3 g di Mg3(PO4)2 (MM = 262,85 g/mol), supponendo che la resa sia del 100%.
A) 6,05 g di MgO; 0,10 mol di H3PO4
B) 12,09 g di MgO; 0,20 mol di H3PO4
C) 3,02 g di MgO; 0,2 mol di H3PO4
D) 24,18 di MgO; 0,2 mol di H3PO4
15. Soluzione
La reazione bilanciata è: 3 MgO + 2 H3PO4 → Mg3(PO4)2 + 3 H2O
quindi se per ottenere 1 mnolecola di Mg3(PO4)2 (262,855 g) sono necessari 3 MgO ( 3 x 40,30), per ottenerne 26,3 g ne occorrono X
X = g di MgO = 12,09 g di MgO
se per ottenere 1 mole di Mg3(PO4)2 sono necessarie 2 moli di H3PO4per ottenere26,3/262,855 moli ne occorrono X
X=( 26,3 / 262,855 )x 2 / 1 = 0,2 Moli
Risposta corretta B
16. Un composto organico costituito da carbonio, idrogeno e ossigeno ha dato all’analisi i seguenti risultati:
C = 63,12%; H = 8,85%; O = 28,03%.
La massa molare del composto è 114,20 g/mol. Indicare la sua formula molecolare.
A) C6H10O2 B) C3H5O C) C3H4O D) nessuna delle altre risposte
16. Soluzione
per calcolare i rapporti semplici tra atomi occorre dividere le % per il peso atomico
C = 63,12%/ 12 = 5,26 grammoatomi
H = 8,85%/1,008 =8,78 grammoatomi
O = 28,03%/16 = 1,75 grammoatomi
dividiamo per il numero più piccolo di grammoatomi otteniamo
C= 3
H =5
O = 1
la somma delle masse di un composto simile è (3 x 12 )+ (5x 1,008) + 16 = 57 g
il quesito però ci dice che la massa del composto deve essere 114,20 g
114/57 = 2
ne consegue che per ottenere la formula del composto richiesta bisogna moltiplicare per due i rapporti trovati
la formula del composto è C6H10O2.
Risposta corretta A
17. Indicare se si ottiene un precipitato di PbCl2 mescolando 500 mL di Pb(NO3)2 0,01 mol/L con 500 mL di HCl
0,01 mol/L [Kps PbCl2 = 1,17 ∙10–5 (mol/L)].
A) si ottiene un precipitato
B) non si ottiene un precipitato
C) dipende soltanto dalla temperatura
D) nessuna delle precedenti risposte
Soluzione
dobbiamo ricordare che il precipitato si ottiene se il valore numerico del prodotto delle concentrazioni degli ioni che andranno a formare il precipitato, supera il valore di Kps
Dai dati vediamo che Pb(NO3) è un sale forte che si dissocia COMPLETAMENTE così come si dissocia completamente l’acido forte HCl
calcoliamo adesso le moli di Pb+2 e di Cl- che sono contenute in 1 litro di soluzione che è la somma tra 500 ml di Pb+2 e 500 ml di Cl-
moli Pb+2 contenute in 500 ml = volume in litri⌈ che il Kps si ottiene dalla dissociazione
PbCl2→ Pb2+ + 2 Cl‒
KPs= ⌈ Pb+2⌉⌈ Cl-⌉2 =1,17 ∙10‒5
sostituendo i valori calcolati si ha
[Pb2+⌉×[Cl-]2 = 2,50×10-3 × (2,50×10-3)2= 2,50×10-3 x (6,25×10-6) = 15,62 x ×10-9=
⌈Pb+2⌉ ⌈Cl-⌉2 1,56 x 10-8
QUESTO VALORE È INFERIORE AL VALORE DEL KPS CHE È 1,17 X 10-5
quindi NON SI OTTIENE PRECIPITAT
Risposta corretta B
18. Indicare il nome IUPAC del solfato rameoso. Cu2SO4
A) tetraossosolfato(VI) di dirame
B) tetraossosolfato(VI) di rame
C) triossosolfato(IV) di dirame
D) tetraossosolfato(IV) di rame
18. Soluzione
vi sono 4 atomi di ossigeno quindi (tetraosso) vi è il solfato quindi Tetraossosolfato vi sono 2 atomi di rame ciò si indica con dirame
il nme IUPAC è tetraossosoltato(VI) di dirame
(il 6 n numero romano, rappresenta il numero di ossidazione dell’atomo centrale che si ottiene moltiplicando 4x n.ossid. dell’ Ossigeno – numero di atomi di rame quindi 4×2=8 8-2=6)
Risposta corretta A
19. Quale volume di una soluzione di H2SO4 al 96% m/m (d = 1,84 g/mL) deve essere prelevato per preparare
1 L di soluzione di H2SO4 2 mol/L?
A) 222 mL B) 111 mL C 11 mL D) 55 mL
19. Soluzione
1 litro di soluzione 2 M che dobbiamo preparare deve contenere 2 x 98 g di H2SO4 = 196 g H2SO4
Sarebbe molto facile se l’H2SO4 fosse un solido perchè basterebbe pesare 196 g e portare ad 1 litro in un matraccio.
MA H2SO4 è un LIQUIDO che però ha una densità 1,84 g/ml e sappiamo che
densità = g/ml il che significa che se si preleva 1 ml in realtà si prelevano 1,84 grammi di acido quindi occorre prelevare Xml per avere 196 g necessari
1 ml : 1,84 = Xml : 196
X = 106,5 ml
ATTENZIONE PERO’ L’ACIDO INIZIALE è AL 96% QUINDI
se prendendo 100 ml in realtà ne prelevo 96 ml reali allora ne devo prelevare X ml tali da corrispondere a 106,5 ml che sono necessarie
100 : 96 = X : 106,5
10650/96 = 110.93 = 111 ml
Risposta corretta B
20. Indicare l’affermazione ERRATA.
A) lo spin è una proprietà intrinseca delle particelle subatomiche al pari di massa e carica
B) l’attrazione inter-elettronica causa una contrazione degli orbitali negli atomi polielettronici
C) la massa è una grandezza estensiva
D) la pressione è una grandezza intensiva
Soluzione
per quanto riguarda la risposta A abbiamo già visto parlato di spin nel quesito n. 4
intensiva, è la grandezza il cui valore dipende soltanto dalle proprietà o dallo stato dei corpi o sistemi considerati, e non dalle dimensioni di questi ultimi. Esempi di grandezze intensive sono la temperatura, la pressione, la densità, l’indice di rifrazione ecc.(risposta D corretta)
Le grandezze estensive, invece, dipendono dalla quantità di materia presente del campione da analizzare quindi la risposta C è corretta
i gruppi di elettroni, ad esempio le coppie solitarie, i legami semplici, i legami multipli e anche singoli elettroni, si respingono quindi non possiamo assolutamente parlare assolutamente di attrazioni essendo due elettroni carichi negativamenmte.
Risposta corretta B
21. Un gas nobile perfetto (He) è contenuto in un recipiente chiuso a volume costante a 25 °C.
A) se il gas viene riscaldato la pressione diminuisce
B) se il gas viene raffreddato il volume aumenta
C) se il gas viene raffreddato la temperatura resta costante
D) se il gas viene riscaldato la pressione aumenta
Soluzione
La teoria cinetica dei gas descrive un gas come un gran numero di piccole particelle che sono in costante movimento casuale. Le particelle muovendosi urtano tra di loro e con le pareti del contenitore. La teoria cinetica dei gas spiega le principali proprietà dei gas quali Pressione Temperatura e Volume. Infatti, l’aumento di temperatura aumenta la velocità media delle molecole quindi aumenta il numero di urti con le pareti del recipiente e quindi aumenta la pressione.
Risposta corretta D
22. Nell’atomo di He sono presenti due elettroni e un nucleo carico positivamente (Z = +2). Sapendo che l’energia di prima ionizzazione dell’elio è 25,6 eV (He → He++ e‒), indicare la considerazione corretta per l’energia di seconda ionizzazione (He+ → He2+ + e‒).
A) l’energia di seconda ionizzazione è maggiore dell’energia di prima ionizzazione per la maggiore attrazione tra
nucleo e l’unico elettrone di He+ rispetto all’attrazione degli elettroni in He neutro
B) l’energia di seconda ionizzazione è minore dell’energia di prima ionizzazione per la maggiore attrazione tra nucleo e l’unico elettrone di He+ rispetto all’attrazione degli elettroni in He neutro
C) non è possibile fare valutazioni quantitative anche approssimate con i dati forniti
D) l’energia di seconda ionizzazione è uguale dell’energia di prima ionizzazione perché i due elettroni sono
indistinguibili
Soluzione
L’energia di ionizzazione di un atomo o di una molecola è L’ENERGIA MINIMA RICHIESTA PER ALLONTANARE UN ELETTRONE e portarlo a distanza infinita, allo zero assoluto, e in condizioni di energia cinetica nulla.
X(g) → X+(g) + e− EI1
dove EI1 rappresenta l’energia di prima ionizzazione
l’energia di seconda ionizzazione è
-
- X+(g) → X2+(g) + e− EI2
più un catione è carico positivamente, tanto più difficile è strappare un ulteriore elettrone, di conseguenza EI1è molto minore di EI2 perché serve più energia rispetto alla prima ionizzazione
Risposta corretta A
23. Cosa succede nella seguente reazione?
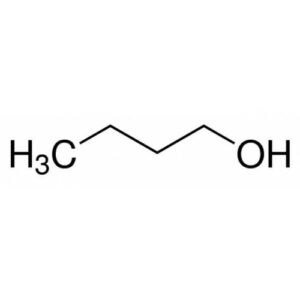
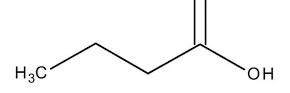
questa è la formazione di un acido carbossilico da un alcol (alcolol 1-n-butanolo → acido butirrico)
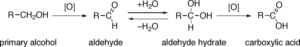
un esempio di ossidazione di un alcool primario è il seguente:
A) l’atomo di carbonio in posizione 1 si ossida
B) l’atomo di carbonio in posizione 1 si riduce
C) nessun atomo di carbonio nella molecola subisce variazione del suo stato di ossidazione
D) l’atomo di ossigeno si ossida
23. Soluzione
come possiamo vedere è il carbonio 1 che si ossida prima ad aldeide poi ad acido. E’ l’analoga reazione che si verifica quando il vino si trasforma in aceto.
Risposta A
24. Indicare quali molecole hanno momento dipolare nullo (trascurando la polarità dei legami C-H).
1: cis-CHF=CHF 2: trans-CHF=CHF
3: CH2=CF2 4: CF2=CF2
A) composti 1 e 3
B) composti 3 e 4
C) composti 1, 2, 4
D) composti 2 e 4
24. Soluzione
abbiamo già visto che il momento di dipolo di legame è dato dal prodotto della carica per la distanza di legame e si misura in coulomb·metro (C·m) nel SI. L’unità di misura comunemente utilizzata in chimica, ma non accettata dal SI, per quantificare un dipolo elettrico è il debye, simbolo D. Un debye vale 3,336·10−30 C·m.
L’esame della geometria delle molecole determina il suo momento di dipolo
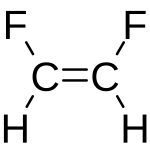
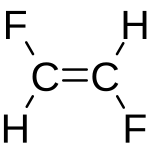 cis difluoroetilene trans difluoroetilene
cis difluoroetilene trans difluoroetilene
la geometria della molecola trans mostra che il momento di dipolo deve essere nullo a causa dei vettori C-F che sono diretti in verso opposto e quindi il momento si annulla.
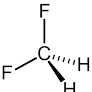
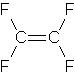
Difluorometano freon 32 tetrafluoroetilene (da cui si ottiene il teflon per polimerizzazione)
in queste due molecole il tetrafluoroetilene ha momento dipolare nullo a causa dei vettori CF che sono in verso opposto a due a due
da quanto detto le molecole con momento dipolare nullo sono tetrafluoroetilene (4) e trans difluoroetilene (2)
Risposta corretta D
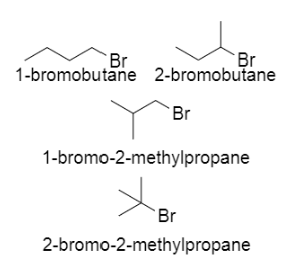
25. Vi sono quattro bromuri alchilici di formula C4H9Br. Quanti tra questi hanno un carbonio terziario?
A) uno
B) due
C) tre
D) nessuno
25. Soluzione
Un atomo di carbonio è detto primario se è legato unicamente ad un altro atomo di carbonio. Un atomo di carbonio è detto secondario se è legato ad altri due atomi di carbonio. Un atomo di carbonio è detto terziario se è legato ad altri tre atomi di carbonio. Come si vede le molecole 3 e 4 possiedono un carbonio terziario mentre le molecole 1 e 2 possiedono un carbonio secondario.
Risposta corretta B
26. Disporre i seguenti anioni in ordine di basicità decrescente.
1: CH3COO‒
2: CH3CH2O‒
3: CH3CH2‒
A) 2 > 1 > 3
B) 3 > 1 > 2
C) 3 > 2 > 1
D) 1 > 2 > 3
26. Soluzione
la basicità di un atomo è la capacità maggior o minore di cedere elettroni di un legame
dal momento che l’ossigeno attira verso di sé gli elettroni è evidente che il composto ionico più basico è CH3CH2‒ che non possiede atomi di ossigeno
La molecola 2 presenta un atomo di ossigeno negativo e possiede una basicità discreta ma inferiore al CH3CH2-
la molecola 1 possiede un gruppo C=O che attira verso di sé i propri elettroni rendendo meno disponibili rispetto alle altre molecole gli elettroni della carica negativa
Risposta corretta C
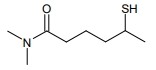
27. Indicare i gruppi funzionali della seguente molecola:
A) ammide e tiolo
B) ammina e tiolo
C) ammina, chetone e tiolo
D) ammide ed estere
27. Soluzione
Il gruppo funzionale di sinistra è un’ ammide disostituita con due CH3,( in quanto alle due estremità dei legami di azoto vi sono 2 gruppi CH3 che nella modalità di scrittura della molecola non vengono scritti ma ci sono)quello di destra è un tiolo che è anche chiamato mercaptano, il nome della molecola è: 5-mercapto-NN-dimetilesanammide.
(Risposta A
28. Quale gruppo funzionale NON può essere presente in una molecola di formula bruta C2H6O2?
A) perossido B) alcol C) emiacetale D) acido carbossilico
28. Soluzione
La molecola di formula C2H6O2 non può avere doppi legami (C2H2+2+2), quindi non può essere ciclica: non può essere un acido carbossilico (che contiene un carbonile C=O), mentre può essere perossido, diolo o semiacetale.
CH3-O-O-CH3 perossido
HO-CH2-CH2-OH diolo o glicol
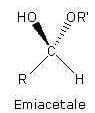
non potendo essere un acido carbossilico non ci potrà essere il gruppo COOOH quindi la risposta corretta al quesito è D
29. Indicare il nome IUPAC del seguente composto.
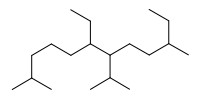
A) 4,9-dietil-1,5-diisopropilnonano
B) 6,10-dietil-7-isopropil-2-metilundecano
C) 6-etil-7-isopropil-2,10-dimetildodecano
D) 7-etil-6-isopropil-3,11-dimetildodecano
Soluzione
le regole IUPAC per determinare il nome di un composto sono:
1) individuiamo la catena principale (la più lunga) e attribuiamo il nome
La catena più lunga possiede 12 atomi quindi il composto è un DODECANO
2) numeriamo la catena principale a partire dal lato più vicino alla prima ramificazione quindi in questo caso da sinistra
3) attribuiamo un nome ai sostituenti e li facciamo precedere dal numero dell’atomo cui è legato
4) costruiamo il nome finale con il nome della catena principale preceduto dal nome dei sostituenti in ordine alfabetico.
Se ci sono sostituenti uguali, li raggruppiamo e li facciamo precedere da tutti i numeri d’ordine separati da virgole e da un prefisso di quantità (di, tri,tetra, ecc.)
la catena più lunga è formata da 12 atomi di C quindi è un dodecano
in posizione 6 e 7 a partire da sinistra vi sono un gruppo CH3-CH2- (etil ) ed un gruppo isopropil (CH3-CH-CH3)
in posizione 2 come in posizione 10 vi è un gruppo CH3 – quindi è un DIMETIL.
concludendo il nome del composto è 6-etil-7-isopropil-2,10-dimetildodecano.
risposta corretta C
30. Indicare i composti con il grado di insaturazione più elevato.
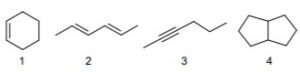
A) composto 3
B) composti 2 e 3
C) composto 4
D) hanno tutti lo stesso grado di insaturazione
Soluzione
una molecola composta da atomi di C ed H è satura quando la formula grezza è CnH2n+2 ( si ha presenza di soli legami sigma).Infatti vi sono atomi di C legati con legame semplice (sigma) tra loro e con i legami sigma rimanenti uniti ad atomi di idrogeno
per esempio CH3-CH3 CH3-CH2-CH3
una molecola è insatura se la sua formula grezza risulta CnH2n ad esempio l’etilene C2H4
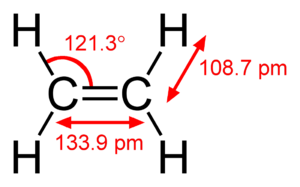
CH2=CH2
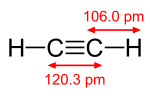
l’insaturazione in generale si ha per la presenza di almeno un legame pi greco o di due legami pi greco (in questo caso la formula grezza è CnH2n-2 ad esempio l’acetilene
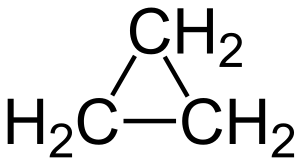
l’insaturazione si ha anche nei composti che formano un ciclo es ciclopropano
veniamo dunque al quesito:
la molecola 1 possiede un doppio legame ed è per questo insatura ma è insaturo anche il resto della molecola perchè gli atomi formano un ciclo in questo caso un cicloesene . Vi sono 2 gradi di insaturazione
la molecola 2 è insatura con 2 doppi legami ed è quindi ha 2 gradi di insaturazione
la molecola 3 ha 2 legami pi greco essendo un triplo legame (1 sigma e 2 pi greco) e quindi ha 2 gradi di insaturazione
la molecola 4 ha 2 cicli uniti quindi ha due gradi di insaturazione
si deduce che tutte le molecole possiedono lo stesso grado di insaturazione
Risposta corretta D
31. Dati 6,022 ∙1024 ioni ferro(III) a disposizione, di quale tra i seguenti composti si ottengono 5 moli? (Kb= 1,8 x 10-5)
A) FeCl3
B) FeSO4
C) Fe2O3
D) Fe
Soluzione
Sappiamo che se una grammo mole contiene 6,02 x 10 23 ioni quindi 6,02 x 10 24
sono contenute in X moli
1: 6,02 x 10 23 = X : 6,02 x 10 24
X= 10 moli
da questa si osserva che 5 moli corrispondono a 10/5 = 2 Fe(III)n
FeCl3 contiene 1 mole di Fe(III) quindi non corrisponde ai dati
FeSO4 contiene Fe(II) e non Fe(III)
Fe corrisponde ad Fe°
ne consegue che l’unica molecola che contiene 2 atomi di Fe(III) è Fe2O3
Risposta corretta C
32. Data una soluzione di ammoniaca 0,1 mol/L, quale valore di pH si avvicina di più al valore reale?
A) 5
B) 7
C) 11
D) 13
32. Soluzione
Partiamo dal considerare che l’ammoniaca è una base, quindi dai dati possiamo calcolare inizialmente il POH
per far questo, ricordiamo che NH3 acquosa è una base debole che si dissocia con un Kb= 1,8 x 10 -5
quindi si può scrivere
NH3 + H2 O ⇐⇒ NH4+ +OH–
Kb= 1,8 x 10 -5 =⌈ NH4+⌉ ⌈OH-⌉ / ⌈NH3 ⌉ ⌈H2O⌉
tuttavia NH3 + H2O si comporta come NH4OH quindi possiamo scrivere
Kb= 1,8 x 10 -5 =⌈ NH4+⌉ ⌈OH-⌉ / ⌈NH4OH⌉
da questa si può ottenere ⌈ OH-⌉ osservando dalla espressione scritta ⌈ NH4+⌉ = ⌈OH-⌉
pertanto scriviamo
Kb= 1,8 x 10 -5 = ⌈OH-⌉2/⌈NH4OH⌉
ma ⌈NH4OH⌉ = 0,1 M quindi
⌈OH-⌉2= Kb x CNH4OH
⌈OH-⌉=√ Kb x CNH4OH
⌈OH-⌉= √1,8 x 10 -5 x 0,1 = √1,8 x 10-6= 1,34 x 10-3
POH= -log ⌈OH-⌉= 3- log 1,34 = 2,87 da cui: pH = 14 ‒ 2,87 = 11,1.
Poichè PH+POH = 14
PH= 14 -2,87 = 11,1
Risposta corretta C
33. L’acido adipico è un acido dicarbossilico a catena satura con sei atomi di carbonio.
A) una mole di questo acido contiene quattro atomi di ossigeno
B) una mole di questo acido contiene un numero di Avogadro di atomi
C) una mole di questo acido contiene dieci moli di atomi di idrogeno
D) una mole di questo acido contiene il doppio delle molecole di una mole di acido esanoico, monocarbossilico
Soluzione
l’acido adipico ha la struttura seguente
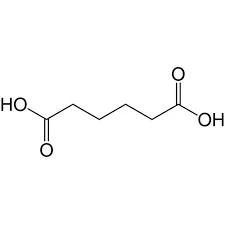
come si vede questa molecola possiede 10 atomi di H
le altre risposte sono errate
La risposta corretta è C
34. Date le soluzioni: HCl 37% m/m, HCl 0,05 mol/L, CH3COOH 0,1 mol/L e HCN 0,05 mol/L, qual è la più indicata da usare in laboratorio per determinare il grado di purezza in % m/m di un barattolo da 100 g di NaOH che si è carbonatato rimanendo aperto all’aria? Si dispone dei seguenti strumenti di laboratorio: buretta da 50,0 mL, pipetta tarata da 20,00 mL, matraccio tarato da 100,0 mL, bilancia analitica, pHmetro, becker, imbuto, navicella per pesata.
A) CH3COOH 0,1 mol/L B) HCl 37% m/m C) HCN 0,05 mol/L D) HCl 0,05 mol/L
soluzione
il campione di cui occorre calcolare il grado di purezza consiste in NaOH che è una base forte. quindi dobbiamo utilizzare un acido forte per la titolazione , e chiaramente non possiamo usare CH3COOH che è un acido debole nè HCN perchè ancora più debole di CH3COOH.
Ne consegue che possiamo usare solo HCl.
Tra le due concentrazioni di HCl che abbiamo a disposizione l’unico ad avere le caratteristiche per titolare NaOH è HCl 0,05 M questo perchè HCl al 37% detto anche acido cloridrico fumante ed essendo abbastanza concentrato, non è una soluzione adatta ad eseguire una titolazione acido forte base forte contrariamente ad HCl 0,05 M che è a titolo noto.
Risposta corretta D
35. Il principio di indeterminazione di Heisenberg sussiste tra le coppie di grandezze:
A) energia e posizione
B) posizione e quantità di moto
C) posizione e tempo
D) quantità di moto ed energia
35. Soluzione
Sappiamo che per conoscere una grandezza fisica in campo macroscopico si adopera in genere uno strumento adatto che fornisce poi il risultato della misura della grandezza fisica cercato. Se, invece, si vuole ottenere il valore di una grandezza fisica in campo microscopico, l’utilizzazione di uno strumento per la misura produce una perturbazione del sistema stesso e molto spesso è notevole.
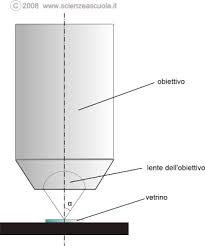
Heisnberg immaginò di usare un microscopio per valutare la quantità di moto cioè l’ energia di un elettrone in movimento.Ovviamente, per poter effettuare la misura, suppose che l’elettrone fosse fermo e si trovasse nel campo visivo del microscopio e per farlo muovere si potesse utilizzare una particella luminosa, il fotone, con lunghezza d’onda λ. Era evidente che l’uso di un fotone con λ grande, faceva uscire l’elettrone dal campo visivo che dipendeva dal rapporto λ/ 2 sen α deve α è l’angolo dell’obiettivo
E’ chiaro che l’uso di una radiazione con un gran valore di λ causa, nell’urto, l’uscita dell’elettrone dal campo del microscopio impedendo la misura della velocità e quindi della quantità di moto. Si potrebbe risolvere il problema con l’uso di una λ piccolissima, ma purtroppo anche in questo caso si verifica un altro fenomeno chiamato EFFETTO COMPTON.
E’ noto infatti che se un fotone, che possiede una quantità di moto pari ad h ν / c ( h è la costante di Plank e ν la frequenza della radiazione (1/λ) e c la velocità della luce) , colpisce un elettrone inizialmente fermo, la sua quantità di moto subirà un a variazione da h ν/c ad h ν‘ /c. L’elettrone colpito si muoverà a sua volta con un’energia cinetica E= ½mv² ed una quantità di moto mv (massa per velocità dove la massa è la massa in movimento cioè m = mο / ( 1- V²/C²)½)
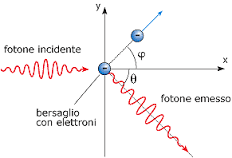
dopo l’urto la quantità di moto deve essere conservata per cui
h ν = h ν‘ +½ mV²
h ν /c = h ν‘/c cos θ + mv cos φ
dove h ν‘/c cos θ è la componente su x della quantità di moto del fotone.
mv cos φ è la componente sull’asse x della quantità di moto dell’elettrone
h ν‘/c cos θ = mv sen φ
si deduce che la quantità di moto del fotone dopo l’urto, è
P× = h ν /c – h ν‘/c cos θ P× = h/c x (ν-ν‘) cos θ
ricordando che
C/ = λ ν/C = 1/λ quindi Px = h/λ (1 – cos θ)
Affinchè il microscopio capti la luce diffusa, è necessario che l’angolo θ dopo l’urto sia compreso nel campo dell’obiettivo cioè tra 90- φ e 90 + φ . Quindi non vi è la possibilità di valutare il momento Px esattamente ma solo nei limiti definiti da 90- φ e 90 + φ . Ma
cos(90- φ) = sen φ e
cos(90+ φ) = sen φ
essendo
Px = h/λ (1 – cos θ) e Px = h/λ (1 + cos θ)
Δpx = h/λ sen φ
Poichè il potere di risoluzione della lente del microscopio nella valutazione della posizione è limitato da λ / sen φ
si ha
Δx ≅ λ / sen φ
pertanto
Δpx x Δx ≅ h/λ sen φ x λ / sen φ
Δpx x Δx ≅ h
questa conclusione ci dice che il prodotto tra queste incertezze è all’incirca pari ad h.
Possiamo concludere dicendo che, se si cerca l’accuratezza nella misura della posizione, diminuisce contemporaneamente l’accuratezza nella misura del momento dell’elettrone e viceversa.
L’espressione matematica ricavata sopra è nota come PRINCIPIO DI INDETERMINATEZZA di Heisenberg.
In relazione a quanto esposto la risposta corretta è B
36. Stabilire l’effetto di un catalizzatore su una reazione di equilibrio scegliendo fra le seguenti opzioni:
A) aumenta l’energia di attivazione
B) aumenta il valore della costante di equilibrio
C) diminuisce il valore della costante di equilibrio
D) diminuisce l’energia di attivazione
Soluzione
l’energia di attivazione è la minima energia necessaria perchè una reazione chimica possa avvenire. Perchè questo avvenga è fondamentale che durante il moto delle molecole vi sia una collisione tra due o più di esse opportunamente orientate nello spazio e dotate di un minimo di energia sufficiente a permettere la collisione per superare malgrado le forze repulsive generate dalle nuvole elettroniche esterne. Tale livello minimo di energia costituisce l’ENERGIA DI ATTIVAZIONE CHE E’ UNA BARRIERA DI POTENZIALE .Se l’energia disponibile è sufficiente, le forze repulsive vengono superate e le molecole coinvolte vengono a trovarsi ad una distanza tale da potersi riorganizzare per originare nuovi composti.
L’energia di attivazione è espressa dall’equazione di Arrhenius
dove:
- k è la costante di velocità
- k0 è un fattore costante (per variazioni di temperatura non troppo elevate)
- ΔE† è l’energia di attivazione (anch’essa costante per variazioni di temperatura non troppo elevate)
- R è lacostante dei gas
- T è latemperatura K assoluta
Grazie all’ energia di attivazione le molecole dei reagenti che collidono di formano il cosiddetto complesso attivato o stato di transizione, la cui esistenza è estremamente breve (tempi dell’ordine di 10−15 s).
Una volta formato lo stato di transizione sono possibili due eventi: il riformarsi dei legami originali, si riottengono quindi i reagenti iniziali, oppure la rottura dei legami iniziali e la formazione di nuovi che danno origine ai prodotti della reazione.
Un catalizzatore è una sostanza diversa dai reagenti ed è coinvolta nella reazione essendo in grado di abbassare l’energia di attivazione
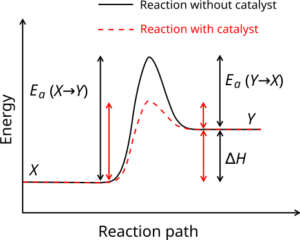
La figura mostra l’Energia di attivazione Ea di una reazione chimica (del tipo X → Y): in nero è indicata l’energia di attivazione di una reazione non catalizzata (a sinistra) e della sua inversa (a destra), mentre in rosso è indicata l’energia di attivazione di una reazione catalizzata (a sinistra) e della sua inversa (a destra).
da quanto sopra è evidente che la risposta corretta è D
37. Stabilire il volume di idrogeno, misurato a TPS, che si forma mescolando 0,10 mol di alluminio e 0,22 mol di acido cloridrico.
A) 4,93 L
B) 2,24 L
C) 1,12 L
D) 2,46 L
soluzione
la reazione di formazione dell’idrogeno è
2 Al + 6 HCl → 2 AlCl3 + 3 H2
se da 2 moli di Al si ottengono 3 moli H2 da o,1 se ne ottengono X X= 3 x 0,1 / 2 = 0,15 moli di H2
Attenzione però, perchè vengono usate 0,22 moli di HCl
In teoria HCl necessario è calcolato da ç
se 2 moli di Al reagiscono con 6 moli di HCl allora 0,1 moli di Al reagiscono con X moli di HCl
X= 6 x 0,1 /2 = 0,3 moli di HCl necessari teoricamente
da questo dato comprendiamo che 0,22 moli di HCl che vengono usate non sono in grado di reagire con tutto l’Al quindi questa quantità condiziona la reazione.
vediamo allora quanto Al viene usato se reagisce con 0,22 moli di HCl
se 0,1 moli di Al reagiscono con 0,3 di HCl allora X moli di Al reagiscono con 0,22 moli di HCl
X= 0,22 x 0,1 /0,3= 0,073
X= 0,073 moli di Al che possono al massimo reagire con 0,22 moli di HCl
adesso calcoliamo quanto idrogeno si ottiene da questa quantità di Al cioè da 0,073 moli
se da 2 moli di Al si ottengono 3 moli di H2 allora da 0,073 moli sene ottengono X
X= 0,073 x 3 / 2 = 0,11 moli di H2
note le moli di H2 utilizziamo l’equazione generale di stato dei gas PV= nRT a condizioni normali (TPS) cioè a 1 atmosfera e 0° C per ottenere il volume corrispondente a 0,11 moli di H2 ed otteniamo
V= 0,11 moli x 0,0821 x 273 / 1 V= 2,46 litri di H2
Risposta corretta D
38. Fra i composti: BCl3 , ClF3 , NCl3 , BF3 e PCl3 indicare quelli caratterizzati da una geometria planare secondo
la teoria VSEPR.
A) BCl3 , ClF3 , PCl3
B) BCl3, BF3, ClF3
C) NCl3, PCl3, BCl3
D) BCl3, NCl3, ClF3
Soluzione
il modello VSEPR (valence shell electron pair repulsion) è basato sull’idea che le repulsioni tra le coppie di elettroni determinano la geometria molecolare. Il modello prevede l’uso del numero sterico
Numero Sterico = elettroni di legame + elettroni di non legame
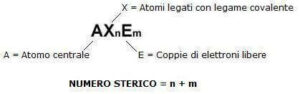
se la molecola ha l’ Atomo centrale con 2 coppie di legame e nessuna coppia solitaria (di non legame) la molecola sarà lineare
la molecola AX2 ha numero sterico 2 e struttura lineare
es Cl-Be-Cl Be: 1s22s12p1 Be lega 2 atomi di cloro e non ha elettroni di non legame
O=C=O C ha la struttura 1S2 2S1 2Px1 2Py1 2Pz1
C lega due atomi di O e non ha elettroni di non legame
Se la molecola ha 3 legami e nessuna coppia elettronica di non legame si ha la struttura VESPR AX3 e struttura trigonale planare
consideriamo BCl3
la struttura elettronica del Boro è 1s22s²2p¹
l’atomo di B ha 3 elettroni disponibili ad accoppiarsi con 3 atomi di cloro. Non vi è alcuna coppia di non legame quindi secondo la teoria VESPR il BCl3 deve avere struttura trigonale planare

consideriamo BF3
per questa molecola si può ripetere il ragionamento fatto per BCl3
quindi BF3 ha struttura trigonale planare

consideriamo ClF3
la teoria VESPR prevede che La struttura VESPR sia del tipo AX3E2 con numero sterico 3+2 =5 e le due coppie di elettroni non condivise occupino due posizioni equatoriali in uno schema di base di bipiramide trigonale.
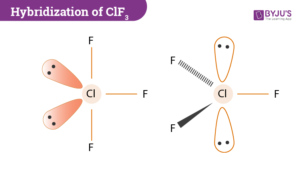
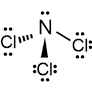
NCl3 e PCl3 sono piramidali
Nel NCl3, l’azoto (N) ha cinque elettroni di valenza e forma tre legami covalenti singoli con il cloro (Cl), che ha sette elettroni di valenza
la struttura elettronica è:
1s2 2s22p3
l’azoto lega 3 atomi di cloro ma ha una coppia di elettroni di non legame e la struttura VESPR è AX3E1.il numero sterico è 4
questo significa che la sua struttura è piramidale
consideriamo PCl3
la struttura del P è [Ne] 3s²3p³
P lega i 3 atomi di cloro ma ha i 2 elettroni 2s liberi quindi ha struttura AX3E1 e la struttura piramidale
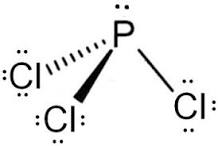
da quanto sopra si evince che la risposta esatta è B
39.Secondo la teoria VSEPR, le specie chimiche NO2 e NO2+ sono, rispettivamente:
A) angolata, lineare B) lineare, lineare C) lineare, angolata D) angolata, angolata
soluzione
Lo ione nitronio NO2+
secondo la teoria VESPR possiede un atomo di azoto con un doppietto elettronico
NO 2 + ha l'azoto come atomo centrale. L'azoto ha un doppio legame con ciascuno dei due atomi di ossigeno (due legami)
e nessuna coppia solitaria di elettroni, risultando in una molecola AX2 che come sappiamo ha forma LINEARE.
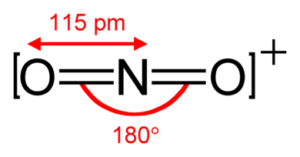 il biossido di azoto NO2
il biossido di azoto NO2
L'atomo di N ha 5 elettroni di valenza, 1S2 2S2 2Px1 2Py1 2PZ1 e possiede un doppietto elettronico.
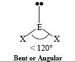
Secondo la teoria VSEPR, la molecola è del tipo AX2E1 e quindi la sua struttura è bent cioè angolare
ne consegue che la risposta corretta al quesito è
40. Stabilire se le molecole NH3 e CCl4 hanno un momento dipolare diverso da zero. A) NH3 no e CCl4 sì B) NH3 sì e CCl4 no C) entrambe hanno un momento dipolare diverso da zero D) nessuna delle due ha un momento dipolare diverso da zero Soluzione l'azoto N possiede elettronegatività (secondo Pauling) 3,04, mentre l'idrogeno 2,1. vi sono quindi 3 dipoli con momento dipolare pari a o.9 (3,04-2,1=0,9),I vettori sono diretti dall' H all 'N . In questo caso non vi è simmetria nelle cariche essendo NH3 a forma piramidale trigonale e quindi nella molecola i vettori dipolo sono asimmetrici e non si annullano tra loro. La molecola di NH3 risulta quindi POLARE. La molecola CCl4 è tetraedrica, con l'atomo di carbonio centrale ibrido sp3 . Il carbonio ha una elettronegatività pari a 2,55 ed il cloro 3,16 per cui i vettori dipolo sono diretti dal C al Cl ma il verso è diverso per le due coppie . Il momento dipolare della molecola pertanto è nullo in quanto si annulla la somma vettoriale dei momenti dipolari e la molecola è quindi apolare. La molecola di CCl4 è quindi APOLARE Risposta corretta B 41.41. Indicare quali, tra le seguenti specie chimiche CO2 , SO2 , O3 , NO2‒ I3‒,, presentano la stessa geometria, in base alla teoria VSEPR. A) SO2 , O3 , NO2‒ B) SO2, NO2‒, I3‒ C) CO2, SO2, NO2‒ D) CO2, O3, I3‒ Soluzione CO2 ha una struttura AX2 quindi risulta lineare SO2 possiede una struttura AX2E1 perchè vi è un doppietto libero su S quindi la molecola è bent cioè angolare O3- gli elettroni dell'atomo centrale respingeranno la nuvola elettronica dei due atomi di ossigeno su ciascuna estremità. Ciò comporta che i gruppi O finali vengano spinti verso il basso conferendo alla molecola O3 una geometria molecolare piegata o forma a V.
NO2-L'atomo di N ha 5 elettroni di valenza, 1S2 2S2 2Px1 2Py1 2PZ1 e possiede un doppietto elettronico. Secondo la teoria VSEPR, la molecola è del tipo AX2E1 e quindi la sua struttura è bent cioè angolare I3- la molecola è del tipo AX2 senza doppietti per cui la struttura è lineare da quanto sopra la risposta corretta è A 42- Indicare quale tra le seguenti specie allo stato elementare presenta il punto di fusione più basso
A) Fe
B) Al
C) W
D) Hg
soluzione
Il punto di fusione è una proprietà delle sostanze cristalline solide. IL punto di fusione è la temperatura a cui la sostanza passa dalla fase solida alla fase liquida. La determinazione del punto di fusione è utilizzata per caratterizzare i materiali cristallini.
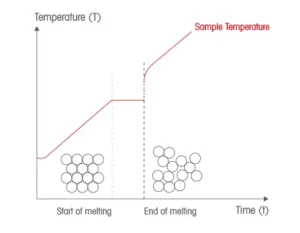
quando si riscalda un solido, il calore fornito serve inizialmente ad aumentare l’energia interna degli atomi che formano il cristallo e per questo la temperatura aumenta. (la retta sale nella figura).Quando i legami tra gli atomi del cristallo incominciano a spezzarsi inizia la fusione e il calore ceduto, stavolta, serve per spezzare i legami e la temperatura rimane costante ( la parte parallela all’asse x nella figura) . La temperatura ricomincia a salire quando tutto il solido è fuso.
i metalli del quesito sono solidi cristallini e l’unico ad essere liquido è il mercurio Hg. Come si intuisce, il mercurio fonde prima quindi questo presenta il punto di fusione più basso.
risposta corretta D
43. Indicare la coppia costituita da ioni isoelettronici.
A) F- , Ca2+
B) F- , Cl–
C) F- , Al3+
D) Ca2+, Mg2+
Soluzione
isoelettronici significa che gli atomi possiedono lo stesso numero di elettroni. Vediamo le configurazioni elettroniche dei singoli atomi
F= [He] 2s²2p⁵ F se acquista un elettrone diventa F-
F- = [He] 2s²2p6 questa struttura coincide con Ne =[He] 2s²2p⁶
F- = ⌈Ne⌉
Cl =[Ne] 3s²3p⁵ se Cl acquista un elettrone diviene Cl-
Cl- =[Ne] 3s²3p6
Ca = [Ar]4s² se Ca in questo caso perde due elettroni diviene Ca2+
Ca2+= [Ar]
Mg = [Ne] 3s² se Mg in questo caso perde due elettroni diviene Mg2+
Mg2+ = ⌈Ne⌉
Al = [Ne]3s23p1
se Al in questo caso perde tre elettroni divieneAl3+
Al3+ = [Ne]
la risposta corretta è C
44. Fra le molecole di H2 O si instaurano legami a ponte di idrogeno, che sono invece assenti fra le molecole di
H2S. Un’evidenza sperimentale si può ottenere dal confronto:
A) dei rispettivi coefficienti di dilatazione termica
B) dei rispettivi indici di rifrazione
C) delle rispettive temperature di ebollizione
D) nessuna delle altre opzioni è corretta
Soluzione
quando il baricentro delle cariche negative non coincide con il baricentro delle cariche positive si crea un momento dipolare risultante non nullo, e si comportano dunque come dei deboli dipoli elettrici.
Le forze intermolecolari contribuiscono a determinare alcune caratteristiche fisiche delle sostanze : allo stato liquido(e ancora di più allo stato solido) queste interazioni sono più forti e causano dunque una maggior compattezza della sostanza, insieme ad una minore mobilità delle molecole.
Un’elevata forza fra le molecole di una soluzione (ad esempio un legame ad idrogeno, come nel caso dell’acqua) ne fa innalzare il punto di ebollizione perché occorre maggior energia per rompere questi legami. Lo stesso discorso si può fare per il punto di fusione.
Rispetto ad H2S la molecola di H2O presenta forti legami idrogeno ( l’O ha elettronegatività 3,5 mentre S ha un’elettronegatività di 2,5).
Questo comporta che per l’acqua bisogna usare maggior energia per l’ebollizione rispetto ad H2S. Ne consegue che per la caratterizzazione delle due molecole è utilizzabile il punto di ebollizione .
Risposta corretta C
45. Data la reazione:
N2 (g)+ 3 H2 (g)→ 2 NH3
si osserva che, quando la temperatura aumenta, la costante di equilibrio diminuisce. Assumendo che ΔH° e ΔS° siano indipendenti dalla temperatura, si può affermare che:
A) la reazione è esotermica
B) la reazione è endotermica
C) la reazione non produce calore
D) nessuna delle precedenti
45. Soluzione
ricordiamo che una qualunque reazione si può scrivere
A+B ⇔ C + D + Q (calore)
come se il calore fosse un elemento dell’equilibrio
se Q aumenta la reazione procede verso sinistra
se Q diminuisce la reazione procede verso destra
IL QUESITO CI DICE CHE LA TEMPERATURA AUMENTA E CHE Keq DIMINUISCE
ciò significa che essendo Keq = ⌈NH3⌉2/ ⌈N2 ⌉ +⌈H2⌉ 3
aumenta il denominatore quindi la reazione procede verso sinistra all’aumentare della temperatura
se osserviamo la reazione generica A + B ⇔ C + D + Q
è ovvio che Q è positivo quindi la reazione produce calore e si ha una REAZIONE ESOTERMICA
sappiamo inoltre che
∑ Hprodotti – ∑ H reagenti =Quantità di calore che si produce nella reazione a P=kirr
se Q è negativo allora prevale la ∑ H reagenti
e la reazione è endotermica cioè avviene con assorbimento di calore
se Q è positivo prevale la ∑ H reagenti
e la reazione è esotermica cioè avviene con produzione di calore
L’EntalpIa è una misura di come il calore viene rilasciato o assorbito da un sistema
se in una reazione A→B
si ha A→B +Q cioè viene rilasciato calore la reazione è detta ESOTERMICA
si ha A→B – Q cioè viene assorbito calore la reazione è detta ENDOTERMICA
da quanto sopra la risposta corretta è A
46. Indicare il pH di una soluzione di ammoniaca 0,01 mol/L (pK = 4,75).
A) 12,44
B) 10,62
C) 9,50
D) 4,75
soluzione
l’ammoniaca in H2O forma il prodotto NH4OH secondo la reazione
NH3 + H2O ⇔ NH4OH
tuttavia NH4OH in acqua si dissocia debolmente formando NH4+ ed OH-
NH4OH ⇔ NH4+ + OH-
la Keq =⌈ NH4+ ⌉ + ⌈OH-⌉ /⌈ NH4OH⌉
nel caso in esame ci viene fornito il PK che non è altro che PK= – log Keq cioè Keq = 10-4,75
aumentiamo l’esponente al numero intero cioè 4,75 diviene 5
la differenza paria 0,25 NON E’ UN NUMERO MA UN LOGARITMO DA CUI DOBBIAMO OTTENERE IL NUMERO CERCANDO IL NUMERO CHE CORRISPONDE AL LOGARITMO 0,25
VEDIAMO DALLE TAVOLE LOGARITMICHE CHE A 0,25 CORRISPONDE IL NUMERO 178 E POICHE’ VI E’ UNO ZERO PRIMA DI 25 ALLORA LA VIRGOLA NEL NUMERO TROVATO VA POSTA ALLA PRIMA CIFRA( SE FOSSE STATO 1 AVREMMO DOVUTO METTERE LA VIRGOLA SULLA SECONDA CIFRA) QUINDI
Keq = 1,78 x 10-5
DALLA ESPRESSIONE DELL’EQUILIBRIO VEDIAMO CHE ⌈ NH4+ ⌉ = ⌈OH-⌉ PERTANTO
Keq = ⌈OH-⌉2 / ⌈ NH4OH⌉
MA ⌈ NH4OH⌉ = 0,01 M = 1 x 10 -2
PERTANTO ⌈OH-⌉2 = Keq x 1 x 10 -2= 1,78 x 10 -5 x 1 x 10 -2= 1,78 x 10-7
⌈OH-⌉ = √ 17,8 x 10-8
⌈OH-⌉ = 4,22 x 10-4 M
POH = – log 4,22 x 10-4
POH= 4 – log 4,22 = 4 – 0,625 = 3,37
essendo POH + PH = 14 allora
PH= 14 – POH e nel caso in esame PH = 14 – 3,37 = 10,63
risposta corretta B
47. Indicare i coefficienti stechiometrici della seguente equazione redox non bilanciata.
Cu + 2HNO3 → Cu(NO3 )2 + NO + H2O
A) 3, 4, 3, 2, 4
B) 3, 2, 3, 2, 2
C) 3, 8, 3, 2, 4
D) 3, 6, 3, 2, 3
Soluzione
la reazione è una ossidoriduzione
vediamo che il rame metallico Cu° si ossida da numero di ossidazione o a numero di ossidazione +2 perdendo 2 elettroni
Il nitrato NO3- presenta l’azoto allo stato di ossidazione (+5 essendo 3 x 2 – 1 =5) e risulta un forte ossidante in ambiente acido. Tende a ridursi a NO2 (N=+4) od a NO (N=+2) a seconda se la soluzione del nitrato sia rispettivamente concentrata o diluita. In questo caso la soluzione deve essere diluita in quanto si ottiene NO
Cu° → Cu+2 +2e
NO3- 3 e → NO
essendo NO3- in ambiente acido occorre aggiungere H+ dalla parte dove c’è più ossigeno in quantità paria al doppio della differenza di O tra destra e sinistra ( in valore assoluto senza segno) in questo caso
la differenza di O è 3 – 1 = 2 quindi la quantità di idrogeno da aggiungere dalla parte di NO3- è 2×2 =4
dalla parte opposta a quella in cui abbiamo aggiunto H+ si aggiunge H2O in quantità poari alla metà degli atomi di H+ aggiunti
NO3- + 4 H+ +3e → NO + 2H2O
in definitiva si hanno le due semireazioni
Cu° → Cu+2 +2e
NO3- + 4 H+ +3e → NO + 2H2O
per bilanciare occorre moltiplicare la prima semireazione per il numero di elettroni della seconda e viceversa
3 ⌈ Cu° → Cu+2 +2e
2 ⌈NO3- + 4 H+ +3e → NO + 2H2O
______________________________________
3 Cu° + 2 NO3- + 8H+ → 3Cu+2 + 2 NO + 4 H2O
la reazione quindi è
3 Cu + 8 HNO3 → 3 Cu(NO3 )2 + 2 NO + 4 H O
i coefficienti sono quindi
3,8,3,2,4
risposta corretta C
48. Una cella per la misura della conducibilità, piena di una soluzione 0,1 mol/L di KCl ha una conduttività di 0,0112 Ohm–1 cm–1 e una resistenza di 510 Ohm.
Indicare il valore della costante di cella.
A) 0,571 cm–1
B) 5,71 cm–1
C) 0,286 cm–1
D) 2,86 cm–1
soluzione
La conduttività elettrica (σ) è una misura della capacità del materiale di condurre una corrente elettrica.
Le unità di conduttività sono Siemens per metro (S/m), o più comunemente milliSiemens per metro (mS/m).
Il Siemens, che è l'unità di conduttanza, è il reciproco dell'Ohm, l'unità di resistenza. Le unità di
conduttività sono talvolta indicate come mhos/metro o millimhos/metro.
La resistività (ρ) è l'inverso della conduttività (ρ = 1 / σ). Le unità di resistività sono Ohm metro (Ωm).
Per un qualsiasi conduttore (sia esso un metallo o una soluzione elettrolitica),la conducibilita’ o conduttanza (simbolo λ) e’ definita come l’inverso della sua resistenza
![]()
Il significato fisico di questa grandezza e’ chiaro: la conducibilita’ di un conduttore e’ una misura della sua capacita’ di farsi attraversare da una corrente elettrica.
L’unita’ di misura della conducibilita’ e’ il Siemens (simbolo S ) : dalla definizione si deduce che 1S = 1Ω-1
La resistenza di un conduttore dipende sia dalla sua natura (cioe’ se si tratta di rame o alluminio o di una soluzione di NaCl) che dalle sue caratteristiche geometriche, cioe’ in ultima analisi, dalla sua forma e dimensione. Matematicamente si scrive
![]()
dove indichiamo con S la sezione e con l la lunghezza di un conduttore o distanza tra due elettrodi di superficie S, e con R la sua resistenza
(se la distanza tra gli elettrodi è1 cm e la superficie 1 cm2allora Kcella =1 e Λ la conducibilità specifica ρ la resistenza specifica )
In questa relazione, il termine l /S tiene conto della geometria del conduttore e se si tratta di una soluzione, della geometria del recipiente che la contiene che chiamiamo cella, mentre il termine ρ dipende solo dalla natura del conduttore e si chiama resistenza specifica o resistivita.
Se sostituiamo l’espressione trovata per R nella definizione di Λ otteniamo:
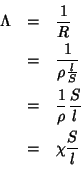
dove abbiamo posto χ = 1 /ρ quindi
Λ= χ S/l
la conducibilita’ di un conduttore dipende dalla sua natura χ e dalla sua geometria S/l
χ viene detta conducibilita’ specifica
χ= Siemens/ cm
Nel caso in cui il conduttore sia una soluzione elettrolitica, la sua conducibilita’ si misura con una cella conduttimetrica
La conducibilità aumenta con il diminuire della distanza degli elettrodi L
La conducibilità aumenta con lʼaumento della superficie immersa degli elettrodi S
La conducibilità aumenta con la concentrazione degli elettroliti presenti in soluzione e viceversa
La conducibilità varia con la natura degli elettroliti presenti in soluzione
La conducibilità varia con la natura degli elettroliti presenti in soluzione
RIASSUMENDO
La conducibilità varia con la natura degli elettroliti presenti in soluzione, e con
la concentrazione C
la superficie immersa S
la distanza degli elettrodi
temperatura della soluzione contenuta nella cella
La misura della conducibilità di una soluzione viene realizzata mediante un dispositivo denominato conduttimetro a cui sono collegati due elettrodi. Questi ultimi, immersi nella soluzione da analizzare, costituiscono la cella conduttimetrica.
Gli elettrodi , solitamente di platino platinato, possiedono una superficie S e sono disposti ad una certa distanza l fra loro
Il rapporto S/l caratterizza l’intera geometria della cella e dipende anche dalle caratteristiche fisiche degli elettrodi. Per questo motivo tale rapporto viene solitamente indicato con K [cm], denominato costante di cella.
Esaminiamo ora qualitativamente i fattori che agiscono sul meccanismo della conduzione e che perciò influiscono sul valore di c.
Tali fattori sono:
- Le concentrazioni ioniche
La capacità di trasportare la corrente da parte di una soluzione dipende dal numero di specie ioniche in essa presenti, e dunque dalla sua concentrazione. Questo fattore è comunque strettamente legato al grado di dissociazione, specialmente per gli elettroliti deboli.
- Le cariche ioniche
Uno ione bivalente trasporta ovviamente, fatte salve le altre condizioni, una quantità di elettricità doppia di uno ione monovalente.
- Le velocità di migrazione degli ioni
Esse sono legate al rapporto carica/raggio, alla massa, alle varie forze d’interazione ione-ione e ione-solvente, nonché alla viscosità di quest’ultimo.
CONDUCIBILITA’ EQUIVALENTE E LEGGE DI KOHLRAUSCH
Per quanto la conducibilità specifica c sia un parametro di fondamentale importanza in conduttimetria, la sua dipendenza dalla carica degli ioni la rende tuttavia inadatta ai confronti tra elettroliti diversi. Perciò è stata elaborata una definizione della conducibilità che fa riferimento ad una mole di cariche elettriche, cioè ad un equivalente di elettrolita.
Questo nuovo parametro viene chiamato conducibilità equivalente (Le) e definito come la conducibilità di una soluzione in cui si trova disciolto un equivalente di elettrolita, situata fra due elettrodi distanti fra loro un centimetro.
Possiamo esprimere la conducibilità equivalente nel seguente modo;
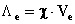
χ rappresenta la conducibilità di una soluzione avente il volume di 1 cm3 (elettrodi di 1 cm2, distanti 1 cm) e moltiplicando questa per il volume nel quale è contenuto 1 equivalente di elettrolita, Ve, espresso in cm3 (o ml), otteniamo la conducibilità di una soluzione nella quale è presente un equivalente di elettrolita, Le.
Inoltre, poiché la normalità di una soluzione è definita da:
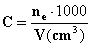
il volume nel quale è sciolto 1 equivalente di elettrolito è:
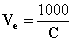
Quindi:
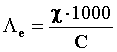
La diluizione delle soluzioni provoca un aumento della conducibilità delle soluzioni di elettroliti forti a causa della diminuzione dell’interazione tra gli ioni, ed un aumento ancora più marcato per gli elettroliti deboli, a causa dello spostamento dell’equilibrio di dissociazione verso la formazione degli ioni. In tutti i casi, dunque, la Λe tende ad un valore limite, a cui si dà il nome di conducibilità equivalente a diluizione infinita,
Λ° [S×cm2/eq].
Questo nuovo parametro è di grande utilità nel confronto tra elettroliti diversi perché risulta indipendente non solo dalla carica, ma anche dalle interazioni interioniche in quanto si riferisce a diluizioni infinite.
Dall’esame dei valori di tale parametro per diversi elettroliti, Kohlrausch formulò la legge della migrazione indipendente degli ioni, in base alla quale la conducibilità equivalente a diluizione infinita di un qualunque elettrolita è data dalla somma fra le conducibilità equivalenti limite dei singoli ioni:
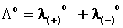
Infine, per gli elettroliti forti esiste un’interessante relazione fra Λe e la radice quadrata della concentrazione espressa in equivalenti/litro (√C), scoperta empiricamente da Kohlrausch e poi elaborata teoricamente da Onsager:

Nel caso in esame, per rispondere al quesito,ricordando che la conducibilità specifica è la conducibilità χ di una soluzione misurata in una cella di 1 cm3 formata da elettrodi di 1 cm2 distanti 1 cm
sapendo quindi che χ= Kcella 1/R
ricordando che
K =(1/resistenza specifica ) x (distanza elettrodi/Superficie elettrodi)
Kcella = χ R = 0,012 ohm-1 cm-1x 510 ohm = 5,71 cm‒1
Risposta corretta B
49. 50 mL di HCl 0,1025 mol/L vengono titolati con 48,5 mL di una soluzione di NaOH 0,1057 mol/L. Quale
indicatore scegliereste per individuare il punto di arresto della titolazione?
A) salda d’amido
B) fenolftaleina
C) ferroina
D) nessuna delle altre sostanz
soluzione
abbiamo giè affrontato nel quesito numero 1 in modo esauriente la scelta dell’indicatore.
in questo caso la salda d’amido è un gel a base di amido, utilizzato come indicatore redox nelle titolazioni iodometriche e iodimetriche per la sua capacità di formare complessi di colore blu scuro con lo iodio.Questo quindi non riguarda la titolazione in esame che è una reazione acido base.
La ferroina è un chelante azotato bidentato. La ferroina viene usata come indicatore redox.
Lo ione [Fe(o-phen)3]2+, di colore rosso intenso può essere ossidato a ferrriina [Fe(o-phen)3]3+, di colore blu intenso. E’ adatto come indicatore in quanto il cambio di colore è rapido e molto pronunciato, oltre che reversibile. Il potenziale della reazione è +1.06 V ( in H2SO4 1M).
Nel nostro caso non abbiamo una reazione redox quindi la Ferroina è da escludere
nel caso in esame il PH di equivalenza è 7 ed una goccia in più di NaOH 0,1 M comporta un cambio di PH da 7 a 9 circa.
Questo ci suggerisce che la fenolftaleina che ha un PK= 9,4 è l’indicatore più adatto alla reazione.A PH inferiori a 8,2 è incolore, a pH superiori a 9,8 i suoi ossidrili perdono i loro atomi d’idrogeno e la molecola impartisce un intenso color porpora alla soluzione.
Risposta corretta B
50. Indicare il pH al punto di equivalenza nella titolazione di 20 mL di un acido debole monoprotico (0,100 mol/L; pKa= 4,0) con 20 mL di NaOH 0,100 mol/L.
A) 5,65 B) 7,00 C) 8,35 D) 11,5
Soluzione
Se abbiamo titolato l’acido debole ed abbiamo raggiunto il punto di equivalenza, significa che tutto l’acido debole HA di è trasformato nel suo sale NaA
il PH che dobbiamo calcolare è quindi il PH di idrolisi del sale formato da acido debole e base forte
Al punto di equivalenza, l’acido debole HA è stato completamente convertito nella sua base coniugata A‒
questo sale provoca una scissione (IDROLISI) dell’acqua causando un aumento di [OH-] per cui la soluzione risultante sarà basica.
Trattandosi di un equilibrio in soluzione, avremo
Kb = [HA] [ OH⁻]/ [A⁻] [H₂O]
Poiché [H₂O] si può ritenere costante allora
Kb = [HA] [ OH⁻]/ [A⁻]
Ricordiamo che [A⁻] è la concentrazione analitica del sale che si indica con Cs.
Se moltiplichiamo numeratore e denominatore per [H⁺] avremo
Kb = [HA] [ OH⁻] [H⁺] / [A⁻][H⁺] cioè
Kb = [HA]/ [A][H⁺] x [ OH⁻] [H⁺]
ma [HA]/ [A⁻][H⁺] =Ka [ OH⁻] [H⁺] = Ka Kw essendo [ OH⁻] [H⁺]= 10 -14 = Kw
Pertanto la Kb si può riscrivere
Kb= Kw/Ka KaKb =Kw
PKa+PKb =14
Kb = Kw/Ka = 10⁻¹⁴ / 1 x 10 ⁻4
Kb = 1 x 10-10
dall’espressione di equilibrio si ha :
Kb = X² / Cs – X
ATTENZIONE!!!!
SE LA DOMANDA FOSSE STATA CALCOLARE IL PH DI UN SALE NaA CON CONCENTRAZIONE Cs allora CS sarebbe stata la concentrazione 0,1 M
INVECE QUI’ NaA SI OTTIENE PER MESCOLAMENTO DI 20+ 20 mL QUINDI LA Cs RISULTERA’ NON PIU’ Cs = 0,1 M MA LA META’ ESSENDO IL VOLUME DI SOLUZIONE AL PUNTO DI EQUIVALENZA, RADDOPPIATO
quindi Cs= 0,05 M
PERTANTO
Kb == X² / (0,05 – X)
Kb = 1 x 10 ⁻¹⁰ = X² / (0,05 – x)
Kb x (0,05– X) = X²
0,05Kb – KbX = X² da cui
X² + Kb X -0,05Kb =0
X² + 10-10 X -0,05x 10-10 =0
[ OH⁻]2+ 10-10 [ OH⁻] + -0,05x 10-10=0
X= -b ± √b2 -4ac / 2a
che risolta fornisce il valore
[ OH⁻] = – 10-10 ±√(10-10)2 -4 X – 0,05 10-10 /2
[ OH⁻] = – 10-10 ±√10-20 + 0,20 X 10-10/2
[ OH⁻] =√ 0,2 10-10/2 = √10 X10-12 = 3,16 X 10-6 M
POH = 6-log 3,162 = 6-0,49 = 5,51
PH = 14 – 5,51 = 8,49
Possiamo approssimare la formula se x è trascurabile rispetto a Cs allora
[OH-]² / Cs = Kb
[OH-] =√Kb x Cs
ricordando che in questo caso Cs=0,05 M
[OH-]=√ 1 x 10 ⁻¹⁰ x 0,05= √5 x 10 x 10⁻12 moli /l = 2,24 x 10-6 moli /L
POH= -log 2,24 x 10-6
POH= 6 – log 2,24
POH= 6 – 0,35 = 5,65
quindi PH =14 – 5,65 = 8,35
il valore così calcolato è molto vicino a quello ottenuto dalla equazione quadratica che era PH=8,49
Risposta corretta C
51. L’idrogeno molecolare è la più semplice delle molecole neutre. La sua energia di dissociazione omolitica (H2 → 2 H) è D°0K = 2,68 eV, mentre la sua energia di dissociazione eterolitica (H2 → H++ H‒) è molto maggiore (ΔH°0K = 17,4 eV). Indicare la relazione per passare dall’una all’altra indicando con EI l’energia di prima ionizzazione dell’idrogeno atomico (H → H++ e‒) e con AE l’affinità elettronica (H + e‒ → H‒).
A) D°0K = ΔH°0K + EI+ AE
B) ΔH°0K = D°0K + EI+ AE
C) ΔH°0K = D°0K ‒ EI‒ AE
D) ΔH°0K = D°0K + EI– AE
Soluzione
l’energia di dissociazione di legame, spesso indicata D0, è una misura della forza di un legame . Viene definita come la variazione di entalpia ΔH° standard quando un legame viene scisso omoliticamente.
(L’energia di dissociazione di legame come ho detto sopra, è chiamata anche entalpia di dissociazione di legame , ma questi termini non sono concettualmente equivalenti, dato che si riferiscono alla entalpia di reazione allo stato standard, e differiscono da D0 di circa 1,5 kcal/mol (6 kJ/mol) nel caso dell’ H quindi solo D°0k = ΔH° standard )
Per una qualsiasi molecola biatomica A:B la scissione eterolitica porta alla formazione di due ioni
A:B → A– + B+ oppure
A:B → A+ + B-
la A:B → A:– + B+
avviene se A è più elettronegativo di B
A:B → A+ + B- se A è meno elettronegativo di B
In ogni caso la scissione eterolitica H2→ A+ + B-
necessita non solo dell’energia per spezzare il legame ( D°ok ) ma anche dell’ENERGIA DI IONIZZAZIONE EI E DELL’AFFINITA’ ELETTRONICA AE
NEL CASO IN ESAME SI HA
la dissociazione omolitica (H2 → 2 H) ha D°0K = 2,68 ev quindi D°0K = ΔH°0K dissociaz
dissociazione (H2 → H++ H‒) ha ΔH°0Kionizz =17,4 ev
una volta che si formano 2 H questi avranno bisogno di altra energia per ionizzarsi ed alla fine sarà necessaria una energia pari a D°0K necessaria a formare H2 + l’ energia di ionizzazione ed affinità elettronica EI+ AE
Ne consegue che ΔH°0K ionizz =17,4 ev = ΔH°0K dissociaz o ( D°ok)+ EI+ AE
Risposta corretta B
52. Un processo chimico isotermo spontaneo è caratterizzato da una variazione negativa dell’energia libera ΔG. Ricordando che la costante di equilibrio è determinata dalla variazione standard dell’energia libera ΔG°, indicare la relazione corretta all’equilibrio, ovvero quando la reazione smette di evolvere verso i prodotti.
A) ΔG = 0
B) ΔG = ΔG°
C) ΔG° = 0
D) ΔG + ΔG° = 0
soluzione
In una reazione chimica l’energia del suo contenuto termico non è tutta disponibile per effettuare lavoro, ciò perché il sistema stesso ne utilizza una sua parte.L’energia libera è definita da
G=H-TS che possiamo anche scrivere G= E+PV -TS
dove
- E = energia interna ( joule)
- P= pressione ( pascal)
- V= volume (litri)
- T= temperatura ( kelvin)
- S=is entropia ( joule/kelvin)
- H= entalpia
- S= entropia (joule)
Essendo H ed S funzioni di stato la loro somma o differenza è sempre una funzione di Stato quindi G è una funzione di stato che dipende esclusivamente dallo stato iniziale e finale del sistema in esame.
Una reazione chimica viene favorita o sfavorita a seconda dell’entalpia e dell’entropia di reazione. Infatti, in una reazione esotermica che comporta un aumento dell’ordine, essendo i prodotti a contenuto entalpico più basso, la variazione di entalpia tende a rendere la reazione spontanea, mentre la variazione di entropia tende ad ostacolare la reazione stessa essendo la variazione di entropia di una reazione spontanea maggiore di zero. Si deduce quindi che per una reazione chimica possiamo scrivere
ΔG = ΔH – TΔS
Se consideriamo una reazione spontanea sappiamo che TΔS è maggiore di ΔH per cui ne risulta un valore di ΔG negativo, mentre per una reazione non spontanea ΔG è positivo, nel caso in cui la reazione sia in equilibrio ΔG=0.
In una trasformazione spontanea ∆G è sempre negativa quindi se ∆G < 0 la reazione è definita esoergonica cioè avviene con produzione di calore (il ΔH dei prodotti è minore del ΔH dei reagenti) ;
una reazione con ∆G > 0 è invece definita endoergonica cioè avviene con assorbimento di calore dall’esterno (il ΔH dei prodotti è maggiore del ΔH dei reagenti)
se una reazione avviene a bassa temperatura e comporta una piccola variazione di entropia, il termine T∆S sarà trascurabile e ∆G dipenderà in gran parte da ∆H per cui si deduce che le reazioni chimiche che avvengono spontaneamente a temperatura ambiente hanno un ∆H negativo.
Da ciò si evince anche che Reazioni fortemente endotermiche possono avvenire soltanto se il termine T∆S è elevato e questo si verifica quando la temperatura è elevata o se vi è un considerevole aumento di entropia e si può dire che :
“L’aumento di temperatura favorisce le reazioni endotermiche e sfavorisce quelle esotermiche”.
Se una reazione è all’equilibrio ΔG è in realazione alla costante di equilbrio secondo la
![]()
![]()
ΔG° = – RT ln Keq
Questa espressione permette il calcolo della Keq di una reazione se si conosce la variazione di energia libera ad una data temperatura.
quindi la risposta al quesito è che la reazione è all’equilibrio quando ΔG =O
risposta corretta A
53. All’interno di un contenitore ermetico a volume costante (1 L) sono contenute 2 mol di diborano B2H6 gassoso a 25 °C. Sapendo che a 150 °C il diborano è completamente dissociato in borano BH3, indicare la pressione nel contenitore a 150 °C.
A) 48,95 atm
B) 69,48 atm
C) 97,91 atm
D) 138,96 atm
soluzione
la reazione di dissociazione è
B2H6→ 2 BH3
da 1 mole di borano si ottengono 2 moli di BH3 quindi da 2 moli se ne ottengono 4
Possiamo quindi applicare la legge di stato dei gas
PV=nRT
P = nRT/V = (4 ∙ 0,0821 ∙ 423,15)/1 = 138,96 atm
risposta corretta D
54. L’1-metilcicloesene reagisce con Br2 e H2O per dare una miscela di bromidrine otticamente inattiva. Indicare quale coppia di stereoisomeri si forma.
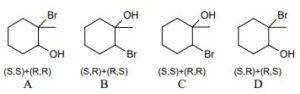
soluzione
il cicloesene reagisce inizialmente con Br2 e forma un composto con un ponte bromonio
ovviamente esso si può trovare sopra o sotto il piano dove si trova l’anello.
lo ione viene attaccato da una molecola di H2O dalla parte dell’ossigeno che ha i doppietti liberi e l’OH si lega al carbonio che è più sostituito come vedi nella figura quindi il prodotto finale contiene il gruppo OH e l’atomo di Br uno sopra il piano ed uno sotto il piano.
La struttura risultante può essere SS o RR
Risposta corretta C
55. Indicare il prodotto della reazione tra acetofenone (1-feniletan-1-one) e idrazina in ambiente basico per KOH
a caldo.
Soluzione
questa reazione è la Riduzione di Wolff-Kishner
che riduce un chetone ad alcano utilizzando l’idrazina H2N-NH2 in ambiente basico

nel caso del quesito il composto ottenuto dal chetone è
che reagisce con OH-
si forma i doppio legame tra i due atomi di azoto ed il C si carica negativamente e l’H dell’NH con OH- forma H2O ed N2 riformando il carbanione che in presenza di H2O forma l’alcano ed elimina OH-
si forma quindi il composto B
Risposta corretta B
56. Quale sequenza di passaggi converte il propino in 4-eptanolo?
A) 1. NaNH2 2. CH3CH2CHO 3. H2(eccesso), Pt
B) 1. NaNH2 2. CH3CH2CH2CHO 3. H2(eccesso), Pt
C) 1. NaNH2 2. CH3CH2CHO 3. H2(1 mol), Pt
D) 1. CH3CH2CH2CHO 2. H2(eccesso), Pt
soluzione
l‘alchino in presenza di NH2- perde l’H terminale a causa dell’acidità che possiede formando lo ione propinuro carico negativamente. Questo composto attacca il carbonio del CO formando un alchino ossidrilato(alcol) che per riduzione catalitica del triplo legame forma l’alcol corrispondente
si ottiene quindi il 4 eptanolo
Risposta corretta B
57. Il dolcificante sintetico aspartame è 160 volte più dolce del saccarosio. Quali prodotti si otterrebbero se l’aspartame fosse idrolizzato completamente in una soluzione acquosa di HCl?
A) un dipeptide e metanolo
B) dimetilestere dell’acido aspartico e fenilalanina
C) acido aspartico, fenilalanina e metanolo
D) acido aspartico ed estere metilico della fenilalanina
Soluzione
l’idrolisi avviene a livello del legame NHCOCNH3+ e del CH3O ne risultano quindi
acido aspartico fenilalanina e metanolo
58. Indicare quali stereoisomeri si ottengono dalla reazione di addizione elettrofila di Br 2 al trans-3-esene.
A) la forma meso del 3,4-dibromoesano
B) una miscela racemica degli enantiomeri treo del 3,4-dibromoesano
C) una coppia di diastereoisomeri
D) tutti i possibili stereoisomeri
Soluzione
si ottiene (2R,3S)-3,4-dibromoesano
per capire meglio usiamo il butene 2 che produce il dibromobutano
la molecola dell’esene viene attaccata dal Br sia sopra il piano che sotto.IL composto che si ottiene ha un piano di simmetria che la divide idealmente in due parti simmetriche e possiede due centri di simmetria. Il composto ottenuto è un composto meso che ha due centri asimmetrici e un piano di simmetria; è quindi otticamente inattivo
Risposta corretta A
59. Indicare il prodotto più probabile che si ottiene dalla reazione:
![]()
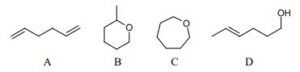
soluzione
l’H+ dell’acido attacca il doppio legame formando un carbocatione . A questo punto due elettroni liberi dell’ossigeno alcolico vengono attratti dalla carica positiva del carbocatione formando un ponte ossigeno che quuindi diventa un etere ciclico
risposta corretta B
60. Indicare il prodotto più probabile della reazione:
Pur avendo l’azoto amminico proprietà nucleofile maggiori dell’ossigeno alcolico quest’ultimo in presenza di tBuOk si trasforma in alcossido che è fortemernte nucleofilo .
Questi con l’anidride acetica reagisce formando l’estere
risposta corretta A.