GIOCHI DELLA CHIMICA 2024 FASE NAZIONALE CLASSE A
Dicembre 22, 20241. INDICARE L’AFFERMAZIONE ERRATA:
A) L’ORO È PIÙ ELETTRONEGATIVO DEL BARIO
B) IL LITIO È MENO ELETTRONEGATIVO DEL BORO
C) LO IODIO È MENO ELETTRONEGATIVO DEL FLUORO
D) LO ZOLFO È PIÙ ELETTRONEGATIVO DELL’OSSIGENO
1. SOLUZIONE
SAPPIAMO CHE GLI IONI CON IONI DI SEGNO OPPOSTO SI ATTRAGGONO, MA CI CHIEDIAMO, IN UN LEGAME CHIMICO, IN VIRTÙ DI QUALI CARATTERISTICHE DI OGNI IONE SI HA L’ATTRAZIONE?
LA CARATTERISTICA PIÙ IMPORTANTE IN QUESTO CASO È L’ELETTRONEGATIVITÀ DI UN ATOMO.
L’ELETTRONEGATIVITÀ È LA PROPRIETÀ DI UN ATOMO DI ATTRARRE GLI ELETTRONI DI UN LEGAME E DIPENDE
DALL’ENERGIA DI IONIZZAZIONE EION E DALL’ AFFINITÀ ELETTRONICA EAFF
ESISTONO DIVERSE SCALE DI ELETTRONEGATIVITÀ
1 SCALA DI PAULING
2 SCALA DI MULLIKEN
3 SCALA DI ALLRED-ROCHOW
4 SCALA DI SANDERSON
5 SCALA DI ALLEN
OGNUNA DI ESSE SI FONDA SU DATI DIVERSI CHE QUÌ PERÒ NON INDICHIAMO.
INDIPENDENTEMENTE DALLA SCALA PRESCELTA, I VALORI DI ELETTRONEGATIVITÀ MOSTRANO UN ANDAMENTO ABBASTANZA REGOLARE LUNGO LA TAVOLA PERIODICA DEGLI ELEMENTI. L’ELETTRONEGATIVITÀ È QUINDI UNA PROPRIETÀ PERIODICA .
I VALORI DI ELETTRONEGATIVITÀ AUMENTANO PROCEDENDO DA SINISTRA A DESTRA LUNGO UN PERIODO, COME ESEMPLIFICATO DAI SEGUENTI DATI
| ELEMENTO | PAULING | MULLIKEN | ALLRED-ROCHOW |
|---|---|---|---|
| LI | 0,98 | 0,97 | 0,97 |
| BE | 1,57 | 1,54 | 1,47 |
| B | 2,04 | 2,04 | 2,01 |
| C | 2,55 | 2,63 | 2,50 |
| N | 3,04 | 2,33 | 3,07 |
| O | 3,44 | 3,17 | 3,50 |
| F | 3,98 | 3,91 | 4,10 |
I VALORI DI ELETTRONEGATIVITÀ INOLTRE CALANO PROCEDENDO DALL’ALTO VERSO IL BASSO LUNGO UN GRUPPO, COME ILLUSTRATO DAI SEGUENTI DATI RELATIVI AGLI ALOGENI
| ELEMENTO | PAULING | MULLIKEN | ALLRED-ROCHOW |
|---|---|---|---|
| F | 3,98 | 3,91 | 4,10 |
| CL | 3,16 | 3,00 | 2,83 |
| BR | 2,96 | 2,74 | 2,74 |
| I | 2,66 | 2,21 | 2,21 |
SE DIAMO UN’OCCHIATA ALLA TAVOLA PERIODICA CON LE ELETTRONEGATIVITÀ DI OGNI ATOMO
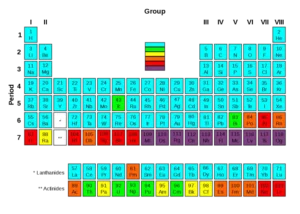
vediamo che:
L’ORO HA ENEGAT =2,54 E BARIO ENEGAT =0,89 QUINDI L’ AFFERMAZIONE A È CORRETTA
IL LITIO HA ENEGAT= 0,98 ED IL BORO 2,04 QUINDI L’ AFFERMAZIONE B È CORRETTA
LO IODIO HA ENEGATIV =2,99 MENTRE IL FLUORO HA ENEGATIV= 3,98 QUINDI L’ AFFERMAZIONE C È CORRETTA
LO ZOLFO INVECE (ENEGATIV= 2,58 È MENO ELETTRONEGATIVO DELL’OSSIGENO ENEGATIV= 3,44 QUINDI L’ AFFERMAZIONE D È ERRATA
RISPOSTA CORRETTA D
2. È BUONA NORMA, PRIMA DI ENTRARE IN UN LABORATORIO CHIMICO:
A) CHIUDERE LE FINESTRE PER EVITARE LA FUORIUSCITA DI SOSTANZE PERICOLOSE
B) PRENDERE VISIONE DELLE SCHEDE DI SICUREZZA DEI PRODOTTI CHIMICI DA MANEGGIARE
C) OCCUPARE IL BANCO PIÙ VICINO ALLE USCITE DI SICUREZZA IN CASO DI EMERGENZA
D) PRESENTARSI AL TECNICO DI LABORATORIO COSÌ CHE POSSA CHIAMARTI PER NOME
2. SOLUZIONE
IN UN LABORATORIO CHIMICO È MOLTO IMPORTANTE TENER CONTO DEGLI ASPETTI DI SICUREZZA LEGGENDO LE SCHEDE DI OGNI COMPOSTO DA MANEGGIARE (AD ES SE VA TRATTATO IN CAPPA, SE SI DEVONO USARE OCCHIALI DI PROTEZIONE SE USARE GUANTI O CAMICI DI PROTEZIONE , ACCERTARSI DOVE VI È UN LAVANDINO PER LAVARE GLI OCCHI IN CASO DI INCIDENTE ECC)
SI DEDUCE QUINDI CHE LA RISPOSTA CORRETTA È B
3. PER EFFETTUARE UNA TITOLAZIONE, SI UTILIZZA:
A) BACCHETTA DI VETRO
B) BURETTA
C) IMBUTO
D) PIASTRA AGITANTE
3. SOLUZIONE
LA FIGURA INDICA IL NECESSARIO



PER LIQUIDI CHIARI SI LEGGE IL VOLUME COL MENISCO VERSO IL BASSO (A SX )
PER LIQUIDI DI COLORE INTENSO CHE NON PERMETTONO DI VALUTARE IL MENISCO INFERIORE (ES KMNO4 VIOLA INTENSO) SI LEGGE IL MENISCO SUPERIORE (A DX)
TRA GLI OGGETTI INDICATI NEL QUESITO È QUINDI LA BURETTA CHE PERMETTE DI EFFETTUARE LA TITOLAZIONE VISTO CHE È IN GRADO DI MISURARE CON PRECISIONE I VOLUMI DI LIQUIDO .
(TUTTAVIA IN UNA TITOLAZIONE SONO NECESSARI TUTTI GLI OGGETTI INDICATI NELLE RISOSTE)
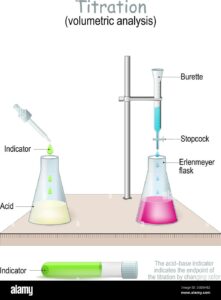
RISPOSTA CORRETTA B
4. INDICARE QUALE OSSIDO DI FERRO NON ESISTE:
A) FEO
B) FE2O3
C) FE3O4
D) FE2O5
SOLUZIONE
GLI STATI DI OSSIDAZIONE POSSIBILI DEL FE SONO + 2 E + 3
FE3O4 CONTIENE ENTRAMBI GLI IONI FE2+ E FE3+ IN QUANTO COMPOSTO DA FE2O3 +FEO,
D È LA RISPOSTA ERRATA IN QUANTO INDICHEREBBERO UN FE+5
5. CONSIDERANDO 10 G DI CIASCUNO DEI SEGUENTI COMPOSTI, STABILIRE QUALE CONTIENE PIÙ ATOMI DI COBALTO.
A) COBR2
B) COCL3
C) COCL2 ∙ 2 H2O
D) COSO4 ∙ 6 H2O
SOLUZIONE
SE IN COBR2 VI È IN ATOMO DI CO IN 10 G VE NE SONO X 218,74 G : 58,93 =10 :X X= 589,3 / 218,74 = 2,7 G
SE IN COCL3 VI È IN ATOMO DI CO IN 10 G VE NE SONO X X= 589,3 /165.29 = 3,56
SE IN COCL2 ∙ 2 H2O VI È IN ATOMO DI CO IN 10 G VE NE SONO X X= 589,3 / 277.6937 = 2,12 G
SE IN COSO4 ∙ 6 H2O VI È IN ATOMO DI CO IN 10 G VE NE SONO X X=589,3/237,93 = 2,47
IL COMPOSTO CHE CONTIENE PIÙ ATOMI DI CO È COCL3
RISPOSTA CORRETTA B
6. SAPENDO CHE LA MASSA ATOMICA DEL RAME È 63,546 U, INDICARE QUALE DEI SEGUENTI ISOTOPI È PIÙ ABBONDANTE:
A) 6329 CU
B) 6529 CU
C) 6729 CU
D) 6331 CU
SOLUZIONE
DA QUESTI DATI SI EVINCE CHE LA RISPOSTA D È ERRATA IN QUANTO CU HA NUMERO ATOMICO 29 E NON 31
IN MOLTI CASI (MA NON IN TUTTI) PER CONOSCERE L’ISOTOPO PIÙ ABBONDANTE BASTA ARROTONDARE LA MASSA MEDIA AL NUMERO INTERO CORRISPONDENTE
L’ISOTOPO PIÙ ABBONDANTE È QUELLO CHE HA LA MASSA ATOMICA CHE SI AVVICINA DI PIÙ A QUESTA MASSA.
NEL CASO IN ESAME LA MASSA MEDIA È 63,54 QUINDI ARROTONDIAMO A 63 U
L’ISOTOPO DI CU CHE È PIÙ ABBONDANTE È QUELLO CON NUMERO DI MASSA 63 U
RISPOSTA CORRETTA A
7. DATE LE SEGUENTI PERCENTUALI DI ELEMENTI DI UN COMPOSTO INCOGNITO CONTENENTE CARBONIO, IDROGENO, AZOTO E OSSIGENO (C = 63,38%, H = 4,26%, N = 9,85%) STABILIRNE LA FORMULA BRUTA. A) C5H4N2O B) C12H16N2O C) C29H2N4O8 D) C15H12N2O4
SOLUZIONE
LA SOMMA DELLE % FORNITE È PARI A 77,49% PERTANTO LA % RIMANENTE È QUELLA DELL’OSSIGENO CIOÈ % O = 22,51
DIVIDIAMO LA % PER IL PESO ATOMICO ED OTTENIAMO
PER IL C 63,38/ 12 = 5,28
PER L’H 4,26/ 1,008 = 4,23
PER L’ N 9,85/ 14 = 0,70
PER L’O 22,51/16 = 1,4
DIVIDIAMO ADESSO I VALORI OTTENUTI PER IL VALORE PIÙ PICCOLO CHE È 0,70
ED AVREMO 5,28/0,70 4,23/0,70 0,70/0,70 1,4/ 0,70
CIOÈ AVREMO C = 7,5 H =6 N = 1 O= 2 PER CUI LA FORMULA BRUTA SAREBBE C7,5 H6 N1 O2
TUTTAVIA SAPPIAMO CHE I RAPPORTI TRA GLI ATOMI DEVONO ESSERE RAPPORTI CON NUMERI INTERI E POICHÈ IN QUESTO CASO C= 7,5 OCCORRE MOLTIPLICARE PER 2 PER OTTENERE NUMERI INTERI QUINDI LA FORMULA BRUTA È
C15 H12 N2 O4
LA RISPOSTA CORRETTA È D
8. UNA MOLE DI ACQUA IN FASE LIQUIDA A 60 °C E UNA MOLE DI ACQUA SOTTO FORMA DI GHIACCIO A ‒20 °C HANNO:
A) LO STESSO NUMERO DI ATOMI
B) LA STESSA DENSITÀ
C) LO STESSO VOLUME
D) NESSUNA DELLE OPZIONI È VALIDA
SOLUZIONE
RICORDIAMO CHE IL NUMERO DI MOLECOLE DI UNA QUALUNQUE SOSTANZA NON VARIA AL VARIARE DELLA TEMPERATURA QUINDI PER H2O ALLE TEMPERATURE INDICATE NON VARIA . CAMBIEREBBE SE L’ACQUA FOSSE PORTATA ALL’EBOLLIZIONE (100°C) IN RECIPIENTE APERTO IN QUANTO LE MOLECOLE SI PERDEREBBERO PERCHÉ PASSEREBBERO ALLO STATO DI VAPORE.
RISPOSTA CORRETTA A
9. IL GHIACCIO SECCO (DIOSSIDO DI CARBONIO ALLO STATO SOLIDO) È UN SOLIDO:
A) MOLECOLARE
B) COVALENTE
C) AMORFO
D) IONICO
SOLUZIONE
IL GHIACCIO SECCO O DRY-ICE È ANIDRIDE CARBONICA (CO2) ALLO STATO SOLIDO E SI OTTIENE QUANDO LA TEMPERATURA RAGGIUNGE I -78 °C. VIENE DEFINITO “SECCO” PERCHÉ IN CONDIZIONI DI PRESSIONE STANDARD L’ANIDRIDE CARBONICA PASSA DALLO STATO SOLIDO A QUELLO GASSOSO PER SUBLIMAZIONE OVVERO SENZA PASSARE PER LO STATO LIQUIDO.

LA STRUTTURA È MOLECOLARE IN CUI LE MOLECOLE SONO TENUTE VICINE DALLE FORZE INTERMOLECOLARI DEBOLI COME LE FORZE DI LONDON. PER QUESTO MOTIVO IL GHIACCIO SECCO SUBLIMA A TEMPERATUA AMBIENTE.
LE FORZE DI LONDON ( FORZE DIPOLO ISTANTANEO-DIPOLO INDOTTO) IDENTIFICANO TUTTE QUELLE FORZE CHE SI PRESENTANO A LIVELLO ATOMICO E MOLECOLARE DOVUTE A MULTIPOLI ISTANTANEI COME RISULTATO DI EFFETTI DI INTERAZIONI TRA NUBI ELETTRONICHE.FANNO PARTE DI UN INSIEME DI FORZE MOLECOLARI CHIAMATE FORZE DI VAN DER WAALS.
RISPOSTA CORRETTA A
10. SECONDO LA TEORIA VSEPR, PER LA MOLECOLA OF2 SI PUÒ PREVEDERE UNA FORMA:
A) AD ANGOLO RETTO
B) ANGOLATA CON UN ANGOLO < 90°
C) ANGOLATA SIMILE ALL’ACQUA
D) LINEARE
SOLUZIONE
PER VALUTARE LA GEOMETRIA DI UNA MOLECOLA SECONDO LA TEORIA VESPR SI USA IL METODO AXE . NELLA SIGLA AXE A È L’ATOMO CENTRALE E HA SEMPRE COME VALORE SOTTINTESO 1. LA X RAPPRESENTA IL NUMERO DI LEGAMI SIGMA CHE SI FORMANO TRA L’ATOMO CENTRALE E GLI ALTRI ATOMI AD ESSO LEGATI E LA E RAPPRESENTA IL NUMERO DI DOPPIETTI SOLITARI DI ELETTRONI (LONE PAIR) PRESENTI NELL’ATOMO CENTRALE. LA SOMMA DI X ED E, DEFINITA COME NUMERO STERICO.
SE CONSIDERIAMO LA MOLECOLA OF2 POSSIAMO OSSERVARE CHE L’ATOMO CENTRALE È LEGATO AD F CON 2 LEGAMI SIGMA MA SAPPIAMO ANCHE CHE L’OSSIGENO POSSIEDE DUE DOPPIETTI ELETTRONICI LIBERI QUINDI SECONDO IL METODO AXE SI HA LA STRUTTURA RELATIVA A AX2E2
PER UNA MOLECOLA DI QUESTO TIPO LA TEEORIA VESPR PREVEDE LA SEGUENTE GEOMETRIA
CIOÈ STRUTTURA ANGOLARE.
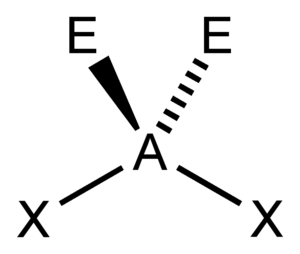
QUESTA STRUTTURA È SIMILE A QUELLA DELL’H2O ANCH’ESSA DEL TIPO AX2E2.
RISPOSTA CORRETTA C
11. UN GAS IDEALE OCCUPA IL VOLUME DI 1 L A 25 °C E A 1 ATM; INDICARE IL SUO VOLUME QUANDO VIENE RAFFREDDATO A ‒10 °C E SOTTOPOSTO ALLA PRESSIONE DI 0,1 ATM.
A) 2,00 L
B) 4,58 L
C) 18,32 L
D) 8,83 L
SOLUZIONE
PER UN GAS CHE SI TROVA NEI DUE STATI 1 E 2 SI HA
P1V1/T1 = P2V2/T2
DA CUI SI OTTIENE
V2 = V1(P1/P2)(T2/T1)
QUINDI SOSTITUENDO I VALORI NUMERICI SI HA
V2 = 1∙ (1/0,1)(263/298) = 8,83 L.
RISPOSTA CORRETTA D
12. INDICARE COSA SUCCEDE ALLA TEMPERATURA DI EBOLLIZIONE DI UN LIQUIDO QUANDO DIMINUISCE LA PRESSIONE CHE INSISTE SULLA SUA SUPERFICIE.
A) SI ALZA
B) SI ABBASSA
C) NON CAMBIA
D) SI ABBASSA O SI ALZA A SECONDA CHE IL LIQUIDO FORMI O NO LEGAMI A IDROGENO
SOLUZIONE
LA TENSIONE DI VAPORE DI UN LIQUIDO DIPENDE DALLA TEMPERATURA. AL CRESCERE DELLA TEMPERATURA AUMENTA L’ENERGIA CINETICA MOLECOLARE E QUINDI LA TENDENZA DELLE MOLECOLE CHE SI TROVANO IN SUPERFICIE A SFUGGIRE DAL LIQUIDO PER PASSARE ALLO STATO DI VAPORE. DI CONSEGUENZA, LA TENSIONE DI VAPORE AUMENTA ALL’AUMENTARE DELLA TEMPERATURA E SE LA TENSIONE DI VAPORE UGUAGLIA O SUPERA LA PRESSIONE AMBIENTE SI OSSERVA IL PASSAGGIO DALLO STATO LIQUIDO A QUELLO DI VAPORE IN FORMA TUMULTUOSA (EBOLLIZIONE) E LA TEMPERATURA A CUI CIÒ AVVIENE È DETTA TEMPERATURA DI EBOLLIZIONE.
OVVIAMENTE, SE LA PRESSIONE AMBIENTE DIMINUISCE, L’ENERGIA CINETICA DELLE MOLECOLE DELLA SUPERFICIE DEL LIQUIDO FA SÌ CHE ESSE PASSINO PIÙ VELOCEMENTE ALLO STATO DI VAPORE TROVANDO MENO OPPOSIZIONE DOVUTA ALLA PRESSIONE SULLA SUPERFICIE,E QUINDI NECESSITANO DI UNA QUANTITÀ DI CALORE INFERIORE PER PASSARE ALLO STATO DI VAPORE, PERTANTO, IL LIQUIDO BOLLE A TEMPERATURA INFERIORE. UN ESEMPIO TIPICO È L’H2O CHE BOLLE ALLA TEMPERATURA DI 100°C SE SI TROVA AL LIVELLO DEL MARE CON UNA PRESSIONE DI 1 ATM MENTRE IN MONTAGNA,ESSENDO LA PRESSIONE AMBIENTE INFERIORE DI 1 ATM, L’H2O BOLLE A TEMPERATURE INFERIORI AI 100°C .
SI DEDUCE CHE LA RISPOSTA CORRETTA È B
13. SAPENDO CHE UN GAS IDEALE (3,30 G) OCCUPA UN VOLUME DI 2,00 L A 150 °C ALLA PRESSIONE DI 1,25 ATM, INDICARE LA MASSA MOLARE DEL GAS.
A) 45,8 G MOL–1
B) 16,2 G MOL–1
C) 0,0218 G MOL–1
D 45,8 U
SOLUZIONE
LA LEGGE DEI GAS È PV=NRT DOVE N= GRAMMI/PESO MOLECOLARE
QUINDI PESO MOLECOLARE = GRAMMI RT/PV
QUINDI MM = 3,30 X 0,0821 X (273+150) / 1,25 X 2
MM = 114,6 / 2,5 = 45,84 G/MOL-1
RISPOSTA CORRETTA A
14. IN UNA MISCELA GASSOSA IDEALE, OGNI COMPONENTE ESERCITA UNA PRESSIONE CHE:
A) DIPENDE DAL NUMERO DI MOLI DEGLI ALTRI COMPONENTI
B) DIPENDE DAL PESO MOLECOLARE DEGLI ALTRI COMPONENTI
C) DIPENDE DALLA PRESSIONE PARZIALE DEGLI ALTRI COMPONENTI
D) È INDIPENDENTE DALLA NATURA DEGLI ALTRI COMPONENTI
14. SOLUZIONE
IN UNA MISCELA GASSOSA IDEALE, LA PRESSIONE PARZIALE DI UN COMPONENTE DI UNA MISCELA DI GAS È LA PRESSIONE CHE QUESTO AVREBBE QUALORA OCCUPASSE, DA SOLO, IL VOLUME A DISPOSIZIONE DELL’INTERA MISCELA ALLA MEDESIMA TEMPERATURA T.
LA PRESSIONE PARZIALE DI UN GAS IN UNA MISCELA NON DIPENDE DAGLI ALTRI COMPONENTI
RISPOSTA CORRETTA D
15. LA FORMAZIONE DI LEGAMI A PONTE DI IDROGENO È RESPONSABILE:
A) DELLA SOLUBILIZZAZIONE DEI SOLIDI IONICI IN ACQUA
B) DELLA MINORE DENSITÀ DEL GHIACCIO RISPETTO ALL’ACQUA
C) DELL’ANGOLO DI LEGAME DI 105° DELL’ACQUA LIQUIDA
D) DEL RELATIVAMENTE BASSO PUNTO DI EBOLLIZIONE DELL’ACQUA
SOLUZIONE
L’ACQUA, QUANDO SOLIDIFICA, NON FORMA SEMPRE GHIACCIO DELLO STESSO TIPO, BENSÌ PUÒ FARLO SECONDO TRE CATEGORIE PRINCIPALI:
A) IL GHIACCIO VETROSO;
B) IL GHIACCIO SOLIDO AMORFO, NON CRISTALLINO,
C) IL GHIACCIO CRISTALLINO, OVVERO QUELLO COSIDDETTO “NORMALE”, COMUNEMENTE CONOSCIUTO NELLE SUE INNUMEREVOLI FORME
LE MOLECOLE DI ACQUA, GHIACCIANDO, SI DISPONGONO FORMANDO UN RETICOLO CRISTALLINO; DI CONSEGUENZA TENDONO A OCCUPARE MOLTO PIÙ SPAZIO RISPETTO A QUANDO SONO IN FORMA LIQUIDA. LE MOLECOLE DI H2O PRESENTANO LEGAMI IDROGENO MOLTO PIÙ STABILI IN FORMA SOLIDA E SI PRESENTANO CON UNA STRUTTURA TETRAEDRICA RIGIDA E QUINDI LE MOLECOLE ALLO STATO SOLIDO SONO PIÙ LONTANE CHE NON LE MOLECOLE DI ACQUA LIQUIDA, IL CHE NE AUMENTA IL VOLUME. IN DEFINITIVA IL GHIACCIO, RISPETTO ALL’ACQUA LIQUIDA, OCCUPA UN VOLUME MAGGIORE. QUESTO, SIGNIFICA UNA DIMINUZIONE DELLA DENSITÀ VISTO CHE D= G/V= GRAMMI / VOLUME.
RISPOSTA CORRETTA B
16. QUALE DELLE SEGUENTI AFFERMAZIONI, RIGUARDO ALLE FORZE INTERMOLECOLARI, È VERA?
A) IL LEGAME IDROGENO È PIÙ FORTE DELLE FORZE DIPOLO-DIPOLO
B) LE FORZE DI DISPERSIONE DI LONDON SONO PIÙ FORTI DEL LEGAME IDROGENO
C) LE FORZE DIPOLO-DIPOLO SI OSSERVANO SOLO IN MOLECOLE IONICHE
D) NESSUNA DELLE ALTRE OPZIONI È CORRETTA
SOLUZIONE
LE FORZE INTERMOLECOLARI SONO FORZE CHE SI ESERCITANO FRA MOLECOLE E/O IONI: SONO GENERALMENTE MOLTO MENO INTENSE DELLE FORZE DI LEGAME INTRAMOLECOLARI (CIOÈ QUELLE CHE TENGONO UNITI GLI ATOMI DI UNA MOLECOLA), MA DETERMINANO UNA SERIE DI IMPORTANTI PROPRIETÀ MACROSCOPICHE DELLA MATERIA.
TUTTE LE FORZE INTERMOLECOLARI SONO DI NATURA ELETTROSTATICA (IONE-DIPOLO, DIPOLO-DIPOLO, LEGAME AD IDROGENO, IONE-DIPOLO INDOTTO….)
LE FORZE INTERMOLECOLARI AGISCONO IN TUTTI GLI STATI DI AGGREGAZIONE DELLA MATERIA; TUTTAVIA, NEI GAS, SONO DI GRAN LUNGA MENO IMPORTANTI CHE NEI LIQUIDI O NEI SOLIDI, PERCHÉ L’ENERGIA L’ENERGIA CINETICA CINETICA DELLE MOLECOLE MOLECOLE DI UN GAS È DI GRAN LUNGA MAGGIORE DELL’ENERGIA COINVOLTA NELLE INTERAZIONI INTERMOLECOLARI.
FORZE IONE-DIPOLO SONO GENERALMENTE LE FORZE INTERMOLECOLARI PIÙ INTENSE. UNO IONE POSITIVO (NEGATIVO) INTERAGISCE CON UNA MOLECOLA POLARE VENENDO ATTRATTO DAL POLO NEGATIVO (POSITIVO) DEL DIPOLO. L’INTERAZIONE IONE DIPOLO HA UNA GRANDE IMPORTANZA NELLE SOLUZIONI. UN TIPICO ESEMPIO È L’IDRATAZIONE DEGLI IONI IN SOLUZIONE ACQUOSA. L’ACQUA È UNA MOLECOLA POLARE E COME TALE
INTERAGISCE INTERAGISCE CON GLI IONI. UNO IONE POSITIVO POSITIVO VERRÀ CIRCONDATO CIRCONDATO DA UN CERTO NUMERO DI MOLECOLE DI ACQUA ORIENTATE CON L’ATOMO DI OSSIGENO (SUL QUALE È LOCALIZZATA UNA FRAZIONE DI CARICA NEGATIVA) VERSO LO IONE; ANALOGAMENTE, UNO IONE NEGATIVO NEGATIVO VERRÀ CIRCONDATO CIRCONDATO DA MOLECOLE MOLECOLE DI ACQUA ORIENTATE CON GLI ATOMI DI IDROGENO (SU CUI È LOCALIZZATA UNA FRAZIONE DI CARICA POSITIVA) VERSO LO IONE.
FORZE DIPOLO-DIPOLO: DATI DUE DIPOLI ELETTRICI, L’ESTREMITÀ POSITIVA DI UNO VIENE ATTRATTA DALL’ESTREMITÀ NEGATIVA DELL’ALTRO E VICEVERSA. LO STESSO TIPO DI INTERAZIONE SI HA FRA MOLECOLE POLARI .
L’INTERAZIONE DIPOLO-DIPOLO È ESOTERMICA: CIÒ SIGNIFICA CHE BISOGNA FORNIRE ENERGIA PER DISTRUGGERE TALE TIPO DI INTERAZIONE. QUESTO È (IN PARTE) IL MOTIVO PER CUI BISOGNA RISCALDARE (CIOÈ FORNIRE ENERGIA AD) UN SOLIDO POLARE PER FARLO FONDERE O UN LIQUIDO POLARE PER PROVOCARNE L’EBOLLIZIONE.
LA TEMPERATURA TEMPERATURA DI FUSIONE O DI EBOLLIZIONE DI UN COMPOSTO COMPOSTO È UN’INDICAZIONE DI QUANTO INTENSE SONO LE FORZE INTERMOLECOLARI CHE TENGONO UNITE LE MOLECOLE NELLA FASE SOLIDA O LIQUIDA: UNA TEMPERATURA DI FUSIONE ED EBOLLIZIONE MAGGIORE INDICA FORZE INTERMOLECOLARI PIÙ INTENSE.
IL LEGAME IDROGENO È UN TIPO DI INTERAZIONE DIPOLO-DIPOLO PARTICOLARMENTE INTENSA E SI VERIFICA QUANDO UN ATOMO DI IDROGENO, LEGATO AD UN ATOMO MOLTO PIÙ ELETTRONEGATIVO,INTERAGISCE CON UNA COPPIA SOLITARIA DI UN ALTRO ATOMO DI QUESTO TIPO.
NELLA MAGGIOR MAGGIOR PARTE DEI CASI, SI PUÒ AVERE FORMAZIONE FORMAZIONE DI LEGAMI IDROGENO QUANDO UN ATOMO DI IDROGENO È LEGATO A UN ATOMO DI N, O O F. INFATTI, QUESTI TRE ELEMENTI HANNO UN’ELETTRONEGATIVITÀ SUFFICIENTEMENTE ELEVATA E DISPONGONO SPESSO DI COPPIE SOLITARIE CON LE MOLECOLE.
IL LEGAME A IDROGENO È UN’INTERAZIONE DIPOLO-DIPOLO QUINDI TRA LE FORZE INTERMOLECOLARI RISULTA LA PIÙ FORTE.
RISPOSTA CORRETTA A
17. QUAL È LA PRINCIPALE FORZA INTERMOLECOLARE PRESENTE TRA LE MOLECOLE DI CO2 (DIOSSIDO DI CARBONIO)?
A) LEGAME COVALENTE
B) LEGAME IONICO
C) FORZE DI LONDON
D) INTERAZIONI DIPOLO-DIPOLO
SOLUZIONE
NELLO STATO GASSOSO LE FORZE INTERMOLECOLARI TRA LE MOLECOLE DI CO2 SONO PRATICAMENTE TRASCURABILI E LE PARTICELLE SONO DISPOSTE IN MODO DEL TUTTO DISORDINATO. DISCORSO DIVERSO PER LA CO2 ALLO STATO SOLIDO, CHIAMATA GHIACCIO SECCO.
LA MOLECOLA DI CO2 È UNA MOLECOLA LINEARE

L’OSSIGENO È PIÙ ELETTRONEGATIVO DEL CARBONIO E QUINDI LA NUVOLA ELETTRONICA SI SPOSTA VERSO L’OSSIGENO CREANDO UN DIPOLO (+ SUL CARBONIO E – SULL’OSSIGENO)
IL DIPOLO È UN VETTORE E COME TALE HA UN DIREZIONE ED UN VERSO OLTRE CHE UN’INTENSITÀ (VALORE NUMERICO) QUINDI NELLA CO2 VI SONO DUE VETTORI DIPOLO CON VERSO DIVERSO
OΔ(-)←+ CΔ(+) →Δ(-)O+
I DUE MOMENTI DI DIPOLO SONO DI UGUALE INTENSITÀ MA DI VERSO OPPOSTO E QUINDI LA MOLECOLA NEL SUO INSIEME NON POSSIEDE MOMENTO DIPOLARE (APOLARE)
ALLO STATO DI GHIACCIO SECCO (SOLIDO) LE MOLECOLE POLARI SI AVVICINANO TANTO DA PROVOCARE UNA INTERAZIONE TRA I DIPOLI CREANDO NELLA MOLECOLA DI CO2 UN DIPOLO ISTANTANEO. QUESTO DIPOLO ISTANTANEO CHE SI FORMA A CAUSA DELL’AVVICINARSI DI UNO DEI DIPOLI DELLA CO2 DI ALTRE MOLECOLE INTERAGISCE CON I DIPOLI DELLA MOLECOLA CHE SI AVVICINA CREANDO UNA FORZA PARTICOLARE TRA LE MOLECOLE.
QUESTA FORZA DI INTERAZIONE DIPOLO-DIPOLO INDOTTO SI CHIAMA FORZA DI LONDON E FA PARTE DI UN GRUPPO DI FORZE DETTE FORZE DI VAN DER WAALS.
LA RISPOSTA A NON È POSSIBILE TRATTANDOSI DI UN LEGAME INTRAMOLECOLARE (INTERNO TRA GLI ATOMI) E NON INTERMOLECOLARE (TRA LE MOLECOLE)
LA RISPOSTA B NON È POSSIBILE PERCHÈ NON SIAMO IN PRESENZA DI IONI.
LA RISPOSTA D NON È POSSIBILE PERCHÈ LA FORZA CHE SI ESERCITA NON È TRA DUE DIPOLI FISSI DELLA MOLECOLA (PER INTENDERCI QUELLI TRA C ED O) MA TRA UN DIPOLO DALLA MOLECOLA (TRA C ED O) ED UN DIPOLO DA QUESTA PROVOCATO (INDOTTO) SU UN’ALTRA MOLECOLA.
NE CONSEGUE CHE LA RISPOSTA CORRETTA È C
18. QUAL È LA DEFINIZIONE DI ENTALPIA STANDARD DI FORMAZIONE (ΔHF°)?
A) LA VARIAZIONE DI ENTALPIA STANDARD ASSOCIATA ALLA FORMAZIONE DI 1 MOL DI UNA SOSTANZA DA ELEMENTI NEL LORO STATO
STANDARD
B) LA VARIAZIONE DI ENTALPIA ASSOCIATA ALLA FORMAZIONE DI UNA MOLECOLA DA DUE ATOMI
C) LA VARIAZIONE DI ENTALPIA ASSOCIATA ALLA FORMAZIONE DI 1 G DI UNA SOSTANZA
D) LA VARIAZIONE DI ENTALPIA ASSOCIATA ALLA DECOMPOSIZIONE DI 1 MOL DI UNA SOSTANZA
SOLUZIONE
L’ENTALPIA STANDARD DI FORMAZIONE ΔH°F DI UN COMPOSTO ALLA TEMPERATURA T È LA VARIAZIONE ΔH CHE ACCOMPAGNA LA FORMAZIONE DI UNA MOLECOLA DI SOSTANZA A PARTIRE DAI SUOI COMPONENTI NEL LORO STATO STANDARD ALLA TEMPERATURA T E ALLA PRESSIONE DI 1 BAR
RISPOSTA CORRETTA A
19. LA TEORIA CINETICO-MOLECOLARE:
A) AFFERMA CHE LA TEMPERATURA DI UNA SOSTANZA NON È CORRELATA ALLA VELOCITÀ DELLE SUE PARTICELLE
B) SOSTIENE CHE LE COLLISIONI TRA LE PARTICELLE GASSOSE SONO RARE E NON INFLUENZANO IL COMPORTAMENTO DEL GAS
C) SOSTIENE CHE LE PARTICELLE GASSOSE OCCUPANO UNO SPAZIO DEFINITO E SONO STRETTAMENTE LEGATE TRA LORO
D) NESSUNA DELLE AFFERMAZIONI È CORRETTA
SOLUZIONE
LA TEORIA CINETICA PER I GAS IDEALI SI BASA SULL’ASSUNZIONE DI ALCUNE IPOTESI:
- LE MOLECOLE DI CUI SONO COMPOSTI I GAS SONO CONSIDERATE PUNTIFORMI ED IN MOVIMENTO CASUALE CON DISTRIBUZIONE UNIFORME NELLO SPAZIO . ESSE COLLIDONO TRA LORO E CON LE PARETI DEL RECIPIENTE CON URTI PERFETTAMENTE ELASTICI.
- IL NUMERO DELLE MOLECOLE È GRANDE COSICCHÉ SI POSSANO USARE METODI STATISTICI.
- IL VOLUME TOTALE DELLE MOLECOLE DEI GAS È TRASCURABILE RISPETTO AL VOLUME DEL CONTENITORE.
- L’INTERAZIONE TRA LE MOLECOLE È TRASCURABILE, ECCETTO DURANTE L’URTO TRA DI LORO CHE AVVIENE IN MANIERA IMPULSIVA.
- LE MOLECOLE SONO PERFETTAMENTE SFERICHE
ESISTE UNA RELAZIONE DIRETTA TRA TEMPERATURA E VELOCITÀ QUADRATICA MEDIA DI UN GAS :
T=(NAM /3R) V2
IL RAPPORTO KB=R/NA , PRENDE IL NOME DI COSTANTE DI BOLTZMANN. DALLE DEFINIZIONI DI ENERGIA CINETICA E VELOCITÀ QUADRATICA MEDIA, NOTIAMO CHE SICCOME K=1/2MV2 È L’ENERGIA CINETICA MEDIA DEL GAS SI OTTIENE LA RELAZIONE
K=2/ 3KBT
PERTANTO L’ENERGIA CINETICA DEL GAS È PROPORZIONALE ALLA SUA TEMPERATURA.
SI DEDUCE CHE LA RISPOSTA A È ERRATA
CONSIDERATO IL PUNTO 1 VEDIAMO CHE GLI URTI NON SONO RARI MA ELASTICI QUINDI LA RISPOSTA B È ERRATA
CONSIDERATO IL PUNTO 4 VEDIAMO CHE LA RISPOSTA C È ERRATA
NESSUNA DELLE RISPOSTE FORNITE DAL QUESITO È CORRETTA QUINDI
RISPOSTA CORRETTA D
20. I LEGAMI COVALENTI:
A) SI FORMANO SOLO TRA ATOMI DELLO STESSO ELEMENTO
B) SI FORMANO ATTRAVERSO LA CONDIVISIONE DI ELETTRONI TRA DUE ATOMI
C) SI FORMANO ATTRAVERSO IL TRASFERIMENTO DI ELETTRONI DA UN ATOMO ALL’ALTRO
D) FORMANO SEMPRE SOLIDI CRISTALLINI
SOLUZIONE
UN LEGAME COVALENTE È UN LEGAME IN CUI DUE ATOMI SOVRAPPONGONO (CONDIVIDENDO) LE RISPETTIVE NUBI ELETTRONICHE CHE DEVONO ESSERE PIÙ O MENO DELLA STESSA ENERGIA E SIMMETRIA . SI FORMANO NUVOLE ELETTRONICHE CHE SI TROVANO NON PIÙ SU ATOMI SINGOLI MA SU TUTTA LA MOLECOLA E SONO CHIAMATE ORBITALI MOLECOLARI. PER OGNI NUVOLA ELETTRONICA MOLECOLARE CHE SI FORMA (CON ENERGIA PIÙ BASSA DELLE NUVOLE ELETTRONICHE DEGLI ATOMI SINGOLI CHE SI UNISCONO) DETTA ORBITALE DI LEGAME,SI FORMA ANCHE UNA NUVOLA ELETTRONICA MOLECOLARE CON ENERGIA PIÙ ALTA DELLE NUVOLE ELETTRONICHE DEGLI ATOMI SINGOLI CHE SI UNISCONO E QUESTA VIENE CHIAMATA ORBITALE DI ANTILEGAME.
SE UN ATOMO FORNISCE I DUE ELETTRONI DEL LEGAME AD UN ALTRO CHE POSSIEDE UN ORBITALE VUOTO IL LEGAME SI CHIAMA LEGAME COVALENTE DATIVO
SE L’UNIONE AVVIENE TRA DUE ATOMI DELLO STESSO TIPO I DUE ELETTRONI DI LEGAME SI POSIZIONANO ESATTAMENTE TRA I DUE ATOMI
SE L’UNIONE AVVIENE TRA DUE ATOMI DIVERSI CON DIVERSA ELETTRONEGATIVITÀ ALLORA SI FORMA UN DIPOLO ELETTRICO ED IL LEGAME È DETTO COVALENTE POLARE
RISPOSTA CORRETTA B
21. CONSIDERANDO L’ENERGIA LIBERA DI GIBBS (ΔG) DI UNA REAZIONE:
A) IL ΔG È MISURATO IN JOULE
B) IL ΔG È INDIPENDENTE DALLA TEMPERATURA
C) UN ΔG POSITIVO INDICA CHE LA REAZIONE È IN EQUILIBRIO
D) UN ΔG NEGATIVO INDICA CHE LA REAZIONE È SPONTANEA
SOLUZIONE
SAPPIAMO CHE G È LEGATO AL DISORDINE DI UN SISTEMA IN QUANTO DALLA REALZIONE
ΔDISORD SISTEMA = = ∆H – T∆S
ΔDISORD SISTEMA 4 PUÒ ESSERE DEFINITO COME L’ENERGIA DISPONIBILE DA PARTE DEL SISTEMA DI PRODURRE LAVORO: INFATTI T∆S È LA PARTE NON DISPONIBILE
QUESTA ENERGIA È DEFINITA ENERGIA LIBERA DI GIBBS
DALL’ESPRESSIONE ΔDISORD SISTEMA = ∆H – T∆S
UNA TRASFORMAZIONE AVVERRÀ SPONTANEAMENTE SE LA ΔG DIMINUISCE E QUINDI SE: ∆G < 0
• QUESTO SUCCEDERÀ SE IL SISTEMA AUMENTA IL PROPRIO DISORDINE (∆S > 0) O SE SI HA UNA DIMINUZIONE DELL’ENTALPIA DEL SISTEMA ( SE LA DIFFERENZA ∑PRODOTTI – ∑REAGENTI È NEGATIVA) INFATTI ∆H < 0 COMPORTA UN AUMENTO DEL DISORDINE DELL’AMBIENTE.
QUANDO ∆G = 0 IL SISTEMA È IN EQUILIBRIO.L’ENTROPIA SIA DEL SISTEMA CHE DELL’AMBIENTE NON CAMBIA
SE ∆G > 0
LA TRASFORMAZIONE NON AVVERRÀ IN MODO SPONTANEO MA ABBISOGNA CHE GLI VENGA FORNITA ENERGIA DALL’ESTERNO.
CONCLUDENDO:
SAPPIAMO CHE ∆G = ∆H ‒ T∆S
DA QUESTA ESPRESSIONE SI EVINCE CHE ∆G DIPENDE DALLA TEMPERATURA T QUINDI MAGGIORE È T MINORE SARÀ ∆G PER CUI LA RISPOSTA B È ERRATA
L’UNITÀ DI MISURA DELL’ENERGIA LIBERA ∆G È IL JAUL/MOLE PER CUI ANCHE LA RISPOSTA A È ERRATA
SAPPIAMO INOLTRE CHE SE UN SISTEMA È ALL’EQUILIBRIO ALLORA ∆G =0
IL ∆G SI MISURA IN J/MOLE (A ERRATA) E DIPENDE DALLA TEMPERATURA INFATTI VALE: ∆G = ∆H ‒ T∆S QUINDI ANCHE LA RISPOSTA B È ERRATA.
UNA TRASFORMAZIONE AVVERRÀ SPONTANEAMENTE SE LA ΔG DIMINUISCE E QUINDI SE: ∆G < 0
QUESTO SUCCEDE SE IL SISTEMA AUMENTA IL PROPRIO DISORDINE (∆S > 0) O SE SI HA UNA DIMINUZIONE DELL’ENTALPIA DEL SISTEMA ( SE LA DIFFERENZA ∑PRODOTTI – ∑REAGENTI È NEGATIVA) INFATTI ∆H < 0 COMPORTA UN AUMENTO DEL DISORDINE DELL’AMBIENTE.
RISPOSTA CORRETTA D
22. INDICARE QUALE TRA I SEGUENTI SALI È IL DIOSSOCLORATO(III) DI POTASSIO
A) KCLO2 B) KCLO4 C) KCLO D) KCL
22. SOLUZIONE
DIOSSO INDICA CHE VI SONO DUE (DI) ATOMI DI OSSIGENO (OSSO)
VEDIAMO DI CHIARIRE COME ATTRIBUIRE IL NOME AD UN SALE :
KCLO4 CORRISPONDE AL MASSIMO DI NUMERO DI OSSIDAZIONE DEL CL ( 4 X 2 -1=7)
QUINDI IL COMPOSTO È PER-CLOR-ATO DI POTASSIO SCONDO LA NOMENCLATURA CLASSICA
SECONDO LA NOMENCLATURA IUPAC E’ TETRA(4) OSSO(OSSIGENO) CLORATO VII (CLORO CENTRALE+ 7 ) DI POTASSIO (PIÙ ESTERNO)
KClO POSSIEDE UN ATOMO DI CL CON N.OSSIDAZIONE PARI A+1 (2 X 1 -1 =01)
IL COMPOSTO È IPO- CLORITO DI POTASSIO OPPURE
SECONDO LA NOMENCLATURA IUPAC MONO(1 ) OSSO (1 ATOMO DI OSSIGENO) CLORATO I (+1 N.O) DI POTASSIO
CHIARIAMO I CONCETTI DI BASE SECONDO LA NOMENCLATURA NON IUPAC
IL CLORO CL POSSIEDE 6 POSSIBILI N.OSSIDAZIONE CHE SONO +7,+5,+3,+1 ,0,-1
SE È IL MASSIMO +7 IL NOME È PER-CLOR-ATO KClO4
SE È SUBITO AL DI SOTTO DI +7 CIOÈ +5 IL SALE È CLOR-ATO (NEI SALI CHE FINISCONO IN ATO IN GENERE ( MA NON SEMPRE ) SI HANNO 3 ATOMI DI O CIOÈ O3 QUINDI LA FORMULA E’ KClO3
SE È AL DI SOTTO DEL +5 CIOÈ DEL CLORATO IN CUI N.O.Cl=+ 3 IL COMPOSTO SI DEFINISCE CLOR-ITO DI POTASSIO KClO2
SE È ANCORA AL DI SOTTO DI +3 CIOÈ +1 IL SALE È CHIAMATO IPO-CLOR-ITO (IPO DAL GRECO SIGNIFICA AL DI SOTTO) DI POTASSIO E LA FORMULA E’ KClO
OVVIAMENTE QUANDO IL N.O. È ZERO, NON SI HA UN SALE MA L’ELEMENTO CLORO CHE È FORMATO DA 2 ATOMI E CIOE’ CL20
SE il N.O. DEL Cl È – 1 IL SALE SI CHIAMA CLOR-URO DI POTASSIO KCl
TORNANDO AL QUESITO PROPOSTO, VEDIAMO CHE LA SOLA SPECIE CON DUE OSSIGENI (DIOSSO) È KCLO2. (CLOR-ITO DI POTASSIO O DIOSSOCLORATO(III) DI POTASSIO)
risposta corretta A
23. Indicare i coefficienti stechiometrici della seguente reazione:
H3BO3 + Na2CO3 → Na2B4O7 + H2O + CO2
A) 4, 1, 1, 6, 1
B) 2, 1, 1, 3, 1
C) 2, 2, 1, 3, 1
D) 1, 3, 2, 2, 4
Soluzione
Questa reazione è una reazione acido H3BO3) base (Na2CO3) e non si hanno variazioni nel numero di ossidazione di B nè di C
per bilanciarla consideriamo il Boro B a destra e sinistra
vediamo che a destra vi sono 4 atomi di B mentre a sinistra solo 1 quindi per bilanciare il B dobbiamo moltiplicare H3BO3 x 4 e otteniamo
4H3BO3
consideriamo adesso l’atomo di C a sinistra e a destra
vediamo che a sinistra vi è 1 atomo e a destra vi è 1 atomo quindi bisogna non moltiplicare nulla.
e a destra possiamo scrivere CO2
quindi a sinistra possiamo adesso scrivere
4H3BO3 + Na2CO3 →
a destra quindi possiamo scrivere Na2B4O7 + CO2
4H3BO3 + Na2CO3 → Na2B4O7 + CO2
adesso dobbiamo bilanciare H ed O
tra H ed Ossigeno deve necessariamente formarsi H2O ma quanta ?
a sinistra vi sono 12 atomi di idrogeno quindi si deve formare la metà cioè 6 molecole di H2O cioè 6 H2O
possiamo scrivere allora la reazione
4H3BO3 + Na2CO3 → Na2B4O7 + CO2 +6 H2O
se controlliamo l’ossigeno a destra e sinistra vediamo che vi sono a sinistra 4 x 3 + 3 = 15 di O e d a destra 7+2+6 =15
La reazione è quindi perfettamente bilanciata
4 H3BO3 + Na2CO3 → Na2B4O7 + 6 H2O + CO2
Risposta corretta A
24. Indicare quanti mL di acqua occorre aggiungere a 100 mL di una soluzione 2 mol/L di H2SO4 per ottenere una soluzione 0,5 mol/L.
A) 150 mL B) 400 mL C) 200 mL D) 300 mL
soluzione
possiamo adoperare 2 metodi
primo metodo
sappiamo che Volume1 x Molarità1 = volume2 per Molarità2
conosciamo M1=2 M V1 = 100 ml
conosciamo M2 = 0,5 M quindi il volume V2 = V1xM1/M2 = 100 x 2 / 0,5 = 400 ml
il volume finale deve essere 400 ml
il volume di partenza era 100 ml quindi l’H2O da aggiungere è 300 ml
Secondo metodo (metodo a croce)
M1 =2
M2=0,5
H2O 0
2-0,5 =1,5 parti di H2O
0,5-0 = 0,5 parti di acido
150 parti di H2O e 50 di acido
0,5 : 150 = 100 = X
X= 300 ml di H2O
come si vede, con questo metodo si ottiene direttamente la quantità di H2O da usare
risposta corretta D
25. Indicare il nome IUPAC del fosfato diacido di potassio
A) idrogenofosfato(V) di potassio
B) idrogenodifosfato(V) di potassio
C) diidrogenofosfato(V) di potassio
D) diidrogenodifosfato(V) di potassio
25. Soluzione
per ottenere il nome IUPAC del fosfato diacido di potassio è KH2PO4 dobbiamo ricordare di calcolare prima il N.O. dell’atomo centrale cioè P
n.o.P = 4×2 -2-1 = +5
come si vede vi sono DUE ATOMI DI IDROGENO quindi il nome è
DIIDROGENOFOSFATO(V) DI POTASSIO
RISPOSTA CORRETTA C
26. Una soluzione viene preparata solubilizzando 1210 mg di un composto (MM = 329,2 g/mol) in 775 mL di acqua. Calcolare la concentrazione in g/L del composto.
A) 0,156 g/L B) 15,6 g/L C) 1,56 g/L D) 0,02 g/L
26. Soluzione
1210 mg sono 1,21 g e 775 ml sono 0,775 L
se in 0,775 vi sono 1,21 g in 1 L ve ne sono X X =1,21/0,775 = 1,56 g/L
Risposta corretta C
27. Quale sostanza è un elettrolita debole in acqua?
A) HCN B) NaOH C) KCl D) HCl
27. Soluzione
NaOH è una base forte che si dissocia completamente in acqua Na+ OH-
HCl è un acido forte che si dissocia completamente
KCl è un sale di un acido forte ed una base debole
HCN è invece un acido molto debole che si dissocia
HCN ⇐⇒ H+ + CN-
Ka=⌈ H+ ⌉ ⌈CN-⌉ / ⌈HCN⌉
dai dati tabulati la Ka= = 6,2 ∙10‒10
Risposta corretta A
28. Volendo separare, a scopo preparativo, il dodecano (Tfus = ‒10 °C; Teb = 216 °C) da una miscela contenente
anche sodio cloruro e acido acetico, quale delle seguenti tecniche è da preferire?
A) cromatografia su strato sottile
B) cristallizzazione del dodecano da soluzione acquosa in cui rimangono il sodio cloruro e l’acido acetico
C) distillazione frazionata da cui si raccolgono in successione le frazioni che contengono dodecano, sodio
cloruro e infine acido acetico
D) estrazione in fase organica del dodecano con una soluzione acquosa di bicarbonato di sodio
Soluzione
La cristallizzazione non è assolutamente adeguata quindi la risposta A è da escludere
La distillazione è un metodo che potrebbe essere adoperato, ma a parte la necessità di temperature elevate per separare il dodecano (216°C) la separazione avverrebbe nella sequenza acido acetico,dodecano e rimarrebbe il cloruro di sodio e la riposta C è errata
In generale un composto organico in presenza di composti inorganici viene separato selettivamente mediante estrazione con solvente organico oppure mediante estrazione su colonna. In questo caso l’estrazione viene effettuata con NaHCO3 che trasforma CH3COOH in CH3COONa e migliora l’efficienza di estrazione.
la risposta corretta è D
29. Fra i composti di formula C3H6O esistono isomeri appartenenti ai seguenti gruppi funzionali:
A) estere, alcol, chetone
B) aldeide, alchene, ammina
C) chetone, alcol, aldeide
D) alchene, acido carbossilico, chetone
soluzione
Andiamo per esclusione:
la risposta B è errata in quanto l’ammina contiene azoto che non è presente nella formula grezza fornita dal quesito.
la risposta D è errata in quanto gli acidi carbossilici contengono 2 atomi di Ossigeno e non uno.
il composto non può essere un alcool a catena LINEARE in quanto l’alcol etilico CH3CH2OH ha 2 atomi di C e non tre come ci dice il quesito e CH3CH2CH2OH ha 8 atomi di idrogeno e non 6
L’ ESTERE possiede 2 atomi di ossigeno CH3COOCH3 quindi la risposta A è errata
Potrebbe essere il chetone CH3-CO-CH3 oppure CH3CH2CHO l’aldeide propilica
ma potrebbe anche essere un alcol ciclico come il ciclopropanolo
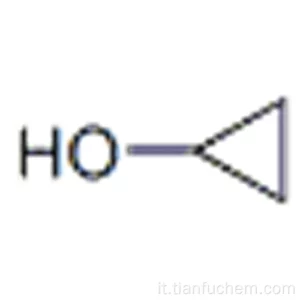
risposta corretta C
30. Esistono 3 isomeri costituzionali (di struttura) di formula C5H12: il pentano, il 2-metilbutano ed il
2,2-dimetilpropano. Indicare quello col punto di ebollizione più basso.
A) pentano
B) 2-metilbutano
C) 2,2-dimetilpropano
D) nessuna, perché le tre molecole hanno la stessa massa molecolare
Soluzione
Il punto di ebollizione dipende dalla presenza o meno di forze che si esercitano tra le molecole (forze intermolecolari)
ad es nell’H2O vi sono legami idrogeno così come nell’acido acetico.
In altre molecole vi sono interazioni più deboli e si verificano quando nelle molecole vi sono ioni, dipoli o dipoli indotti. Tra questo tipo si forze vi è la forza di London interazione dipolo istantaneo-dipolo indotto.
le formule delle molecole sono

![]()
A B C
più basso è della molecola con i legami intermolecolari più deboli. Le forze di London sono le uniche presenti e sono più deboli. Queste forze molecolari sono minori se la superficie di contatto tra le molecole è minore quindi tra le molecole presentate nel quesito quella che presenta minore superficie è il 2,2 dimetilpropano
risposta corretta C
