DROGHE D’ABUSO: CANNABIS SATIVA -ASPETTI ANALITICI
Settembre 22, 2024Basta un po’ di marijuana per rovinare un cervello adolescente (da Le Scienze)

(pianta di cannabis sativa)
Cominciamo col dire che l’uso delle droghe porta alla compromissione delle strutture cerebrali con gravi implicazioni delle facoltà cognitive, del ragionamento, dell’apprendimento e della gratificazione dell’individuo, con conseguenti effetti sull’adattamento sociale (Cohen P., 2004).
Le moderne tecniche di neuroimaging che permettono la visualizzazione le aree cerebrali, hanno consentito di individuare nel cervello di chi utilizza sostanze stupefacenti, le modificazioni, talora permanenti, indotte dalle droghe, con ripercussione sullo sviluppo e sul funzionamento cerebrale. Infatti tali tecniche (TAC, Risonanza Magnetica Nucleare, PET, SPECT) rivelano diversi aspetti della struttura o del funzionamento cerebrale, dell’anatomia e della composizione tissutale, dei processi biochimici, fisiologici e funzionali, dell’attività dei neurotrasmettitori, della distribuzione delle sostanze, ecc..
Ciò permette la visualizzazione, oltre che della sede e dell’estensione del danno cerebrale, anche dell’impatto che i processi mentali hanno sull’attività cerebrale.
Hashish e marijuana hanno spesso effetti di tipo permanente sul sistema dei recettori encefalici deputati al controllo delle emozioni e dell’ansia, quali la serotonina o l’adrenalina. Per tali ragioni la cannabis, al pari di altre sostanze psicotrope quali la cocaina e i derivati amfetaminici, gli allucinogeni ma anche l’alcol, può condizionare lo sviluppo psico-emozionale con distorsione della personalità, in taluni casi irreversibile, ovvero senza remissione una volta sospeso l’utilizzo.
Le scansioni di risonanza magnetica di alcuni soggetti di 14 anni che avevano consumato cannabis solo una volta o due evidenziano alterazioni nel volume di alcune aree cerebrali, come l’amigdala, coinvolta nelle emozioni, e nell’ippocampo, coinvolto nei processi di memoria e nelle abilità spaziali

IN FIGURA è mostrato il confronto tra le scansioni di risonanza magnetica del un cervello di un adolescente che ha fatto uso limitato di marijuana (riga in alto) con quello di un adolescente che non ne ha fatto uso (riga in basso): sono evidenti le alterazione di volume in specifiche aree cerebrali (Credit: Orr et al., JNeurosci, 2019)
Il consumo occasionale di marijuana – anche solo per una o due volte – è in grado di produrre nel cervello dei ragazzi un incremento del volume di diverse regioni nel cervello, secondo uno studio pubblicato nel 2018 SUL JOURNAL OF NEUROSCIENCE da un gruppo di ricercatori dell’Università del Vermont guidati da Hugh Garavan e colleghi di un’ampia collaborazione internazionale. Nell’ambito di un vasto programma di studio sullo sviluppo cerebrale e la salute mentale dei giovani europei chiamato IMAGEN, gli autori hanno analizzato con tecniche di imaging cerebrale il cervello di 46 quattordicenni di Irlanda, Inghilterra e Francia e Germania che avevano riferito di aver consumato cannabis una volta o due.
Le scansioni di risonanza magnetica hanno mostrato in questi consumatori saltuari di cannabis un volume maggiore della materia grigia nelle aree ricche di recettori per i cannabinoidi rispetto ai non consumatori.
Queste aree cerebrali sono quelle a cui si legano non solo gli endocannabinoidi endogeni che hanno la funzione di messaggeri del sistema nervoso centrale, ma anche cannabinoidi di sintesi come il tetraidrocannabinolo (THC), uno dei maggiori principi attivi contenuti nella cannabis.
Tra le aree più interessate dall’alterazione di volume vi erano l’amigdala, coinvolta nei processi di elaborazione della paura e delle altre emozioni, e l’ippocampo, coinvolto nella memoria e nelle abilità spaziali. Queste differenze erano indipendenti da diverse possibili variabili in grado di confondere il risultato, quali sesso, status socioeconomico, consumo di alcool e di nicotina.
Il risultato appare ancora più significativo se si considera che i ricercatori hanno dimostrato una correlazione tra l’alterazione della materia grigia negli utilizzatori di cannabis di basso livello e gli scarsi punteggi nei test di valutazione dell’ansia e delle capacità di ragionamento.
Andreas Zimmer e colleghi dell’Università tedesca di Bonn hanno esaminato gli effetti della somministrazione regolare di bassi dosaggi di THC su topi giovani (due mesi), adulti (12 mesi) e anziani (18 mesi). Hanno così scoperto che nei topi giovani la somministrazione compromette le prestazioni di apprendimento e memoria.
L’azione del principale componente della cannabis, il THC (Tetraidrocannabinolo) avverrebbe in primo luogo attraverso l’interazione con i recettori per i cannabinoidi endogeni (o endocannabinoidi), ma anche con una molecola chiamata CREB (cAMP responsive elements binding protein) che è un importante fattore di regolazione di molti geni, ed è nota per avere un ruolo anche nel corretto funzionamento del cervello.
La conclusione di una ricerca pubblicata lo scorso anno sulla base di uno studio su più di 1000 soggetti seguiti per quasi quattro decenni, evidenziava una correlazione tra il consumo dello stupefacente durante l’adolescenza e un declino del quoziente intellettivo in età adulta.
Gli effetti neurologici e psichiatrici sono in relazione alle aree cerebrali nelle quali sono distribuiti i recettori dei cannabinoidi che interagiscono con i principi attivi contenuti nella cannabis e vanno a modificare il funzionamento dei sistemi dei neurotrasmettitori legati a questi recettori.
Biosintesi del THC
I preparati psicoattivi (THC) della Cannabis terapeutica sono secreti dai tricomi dall’infiorescenza femminile sotto forma di resina.La condensazione del geranil-pirofosfato e dall’acido olivetolico generano l’acido cannabigerolo (CBGA), il quale è ciclizzato dall’enzima THCA sintassi per dare l’acido Δ-9 tetraidrocannabinoide, L’acido Δ-9 Tetraidrocannabinolico è la forma principalmente biosintetizzata dalla pianta di Cannabis, non-psicoattivo, ovvero, privo di effetti stupefacenti sul cervello.
La Cannabis è consumata sotto forma di “erba di “resina” o di “olio”.Il vocabolo “erba”(marihuana) designa una miscela di foglie,di semi e di tutte le parti delle piante femmine e maschi (e non unicamente le sommità fiorite). La “resina”(hashish) è invece un agglomerato di foglie,di fiori,di semi e di resina propriamente detta. L’ “olio “infine è un estratto di Cannabis in metanolo o in etere di petrolio. ‘
I principi attivi sono costituiti da circa 30 derivati del 2-(2-isopropil-5-metilfe nil)-5-pentilresorcinolo , noti con il nome di “cannabinoidi “.
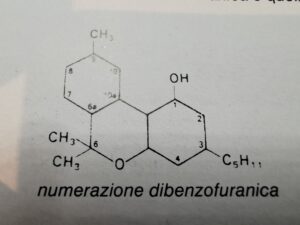
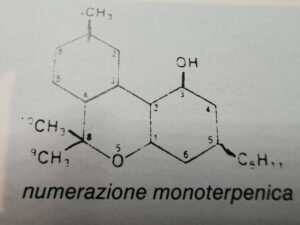
Per quanto riguarda la nomenclatura,esistono due tipi di numerazione, a seconda che si utilizzi la numerazione dibenzofuranica o quella monoterpenica
i cannabinoidi sono:
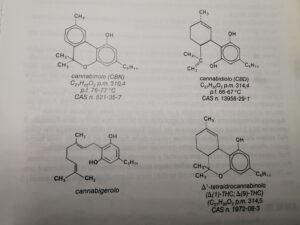
sono rispettivamente cannabidiolo cannabinolo cannabidiolo cannabigerolo Δ(1) 0 Δ(9) Tetraidrocannabinolo (THC)
(numer.dibenzofuranica o monoterpenica)
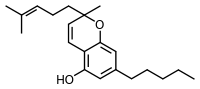
cannabicromene ( ricerche scientifiche hanno mostrato che può avere effetti antivirali ed antinfiammatori)
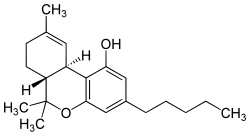
acido Δ(9) Tetraidrocannabinolo (THCA)
La sintesi del delta-8-THC parte dall’acido cannabigerolico o CBGA, la forma acida del CBG. Questo cannabinoide è la molecola di base a partire dalla quale si sintetizzano altri cannabinoidi, e viene considerato come “la cellula staminale della cannabis”. Il THCA si sviluppa nella marijuana matura a partire da questa molecola di cellule staminali, e quando le piante vengono raccolte, il THCA che contengonoviene decarbossilato per azione sia del calore che della luce UV, perdendo una molecola di CO2 e trasformandosi in delta-9-THC o THC. Dopo di che avviene un processo di ossidazione che trasforma questo composto in delta-8-THC, la sostanza che si trova nei fiori di cannabis quando questi sono ancora freschi, ovvero non essiccati.
I cannabinoidi più importanti sono il cannabidiolo (CBD), il cannabinolo (CBN), il (-)-trans Δ(9)-tetraidrocannabinolo Δ(9)-THC ; Δ(1 )-THC), il (–)-trans Δ(8)–tetraidrocannabinolo
Δ(8)-THC ; Δ (6)-THC) e l’ acido Δ(9)-tetraidrocannabinolico.
La quantità dei principali costituenti varia da 0 a 5% in funzione di fattori climatici e genetici. Quasi tutta l’attività psicomimetica dipende però dal Δ(9)-THC (tale attività è in genere 20 volte maggiore di quella del Δ(8)-THC ).
Nella pianta fresca i cannabinoidi esistono inizialmente sotto forma di acidi carbossilici. Sotto l’effetto del calore o nel corso della maturazione questi acidi vengono decarbossilati e convertiti in cannabinoidi neutri. Così l’acido tetraidrocannabinolico produce Δ(9 )-THC. L’ossidazione o la deidrogenazione selettiva del Δ(9)-THC porta alla formazione di CBN con perdita di attività psicotropa.
Di conseguenza il tenore dei diversi cannabinoidi varia non solo con l’origine della pianta ma anche con l’epoca della raccolta e l’anzianità del campione.Per tutte queste ragioni la determinazione dell’origine in funzione ad esempio del cromatogramma è estremamente delicata: in un mese il tenore di CBD e THC (per grammo di pianta secca) può passare da O a 70 mg o da O a 15 mg rispettivamente.
I semi di una stessa pianta, seminati in differenti paesi, producono piante di composizione simile e questo dimostra come l’influenza geografica e l’influenza climatica non sono determinanti.
Il principale costituente psicoattivo è il Δ(9)-THC, la cui concentrazione determina la potenza della droga.Il contenuto medio varia dall’ 1% al 3% e al 5% rispettivamente nella marihuana, nel ganja e nell ‘hashish.
Il cannabinolo ed il cannabidiolo possono essere presenti anche in grandi quantità ma hanno scarsa attività.
La modalità usuale di consumo della cannabis è rappresentata dalla inalazione con il fumo con cui il Δ(9)-THC viene rapidamente assorbito dagli alveoli polmonari e passa nel torrente circolatorio dove viene rapidamente metabolizzato a 11-idrossi- Δ(9)-THC il quale vien poi altrettanto rapidamente convertito a diversi metaboliti polari il principale dei quali è l’acido 11-nor Δ (9)-THC-9-carbossilico. A dosi elevate si ha una perdita di memoria e un deterioramento delle capacità mentali.A questa disintegrazione temporale si aggiunge una tendenza a confondere il passato, il presente ed il futuro e una diminuzione del tono muscolare e della sicurezza dei gesti.
ANALISI QUALITATIVA
La maggior parte dei test colorimetrici utilizzati per l’identificazione dei cannabinoidi sono basati sulla presenza dei due costituenti inattivi cannabidiolo e cannabigerolo (e dei corrispondenti acidi).
Gli estratti di hashish danno con il reattivo di BEAM (soluzione di KOH al 5 % in etanolo)una intensa colorazione porpora.
il Beam test, è un saggio che nasce circa cento anni fa ed è ancora utilizzato dalle Forze dell’Ordine che identifica la Cannabis, qualunque tipo, ma non è specifica e non discrimina la varietà stupefacente ad alto contenuto di tetraidrocannabinolo (THC).
Infatti il THC non reagisce al Beam test, ma gli altri cannabinoidi sì ed in particolare il cannabidiolo (CBD) forma un idrochinolo: il Cannabidiolchinone (CBDQ) molecola intensamente colorata di rosso.
Secondo alcuni Autori (Mechoulam,Ben-Zui e Gaoni),nelle condizioni del test di BEAM,il cannabidiolo viene ossidato per formare il chinone monomero (a)e il chinone dimero (b):
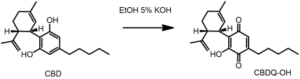

Il colore è dovuto agli anioni di questi due chinoni. Il chinone (a) è stato correlato con un prodotto di ossidazione del Δ1(6)-THC.
I cannabinoidi sono in grado di dare prodotti colorati essendo di natura fenolica.
Così il Δ (1)-THC, dopo cromatografia, acquista una colorazione violetta. L’olio attivo, estratto dalla marihuana, è di colore rosso; per prolungata esposizione all’aria diventa scuro.
Una soluzione in etere di petrolio di Δ (3)-THC, dopo cromatografia, è di colore blu.
Cromatografia su strato sottile
Apparecchiatura
- camera cromatografica Desaga-Heidelberg
- lastre cromatografiche al gel di silice G, 1O x 20 cm, spessore 0,250 mm(spruzzate con dietilammina prima di essere utilizzate)
Reattivi
- cannabinolo , cannabidiolo, (9)-THC, standard di riferimento
- xilene, esano
- dietilammina
- reattivo Fast Blue B
- reattivo di Duquenois
Procedimento
Si preparano soluzioni standard dei principali cannabinoidi (cannabinolo,cannabidiolo e (9)-THC) a concentrazioni di 1 mg/ ml in cloroformio.
Si prepara poi una soluzione cloroformica di campione in esame a concentrazione di circa 10 mg/ ml.
Si deposita quindi sulla lastra cromatografica 1 µI di ciascuna soluzione e si eluisce con miscela xilene/esano/dietilammina (25:10:1).
Si asciuga la lastra all’aria e si spruzza poi con la soluzione di Fast Blue B o con il reattivo di Duquenois.
Con la soluzione Fast Blue B
il cannabidiolo dà una colorazione arancio,
il cannabinolo una colorazione violetta
il (9)-THC una colorazione rossa.
Icolori possono essere intensificati spruzzando la lastra con soluzione di NaOH 1 N o esponendo la lastra a vapori di ammoniaca.
Con il reattivo di Duquenois, (2 g di vanillina, 2.5 mL di acetaldeide e 100 mL di etanolo) spruzzando ancora la lastra con HCl, i cannabinoidi danno una colorazione violetta.

la figura mostra il colore
Di seguito sono riportati i valori di R1 x 100.
| R,x 100 | |
| cannabidiolo | 36 |
| cannabinolo | 20 |
| D.(9)-THC | 29 |
I principali massimi cadono, in soluzione etanolica, a:
- cannabidiolo: 274 e 281 nm
- cannabinolo: 286 nm
– Δ-9-THC: 278 e 283 nm
– Δ-8-THC: 278 e 283 nm
- cannabigerolo : 273 e 288 nm
- cannabicromene : 281 nm
- cannabiciclolo : 275 e 283 nm
SPETTRI INFRAROSSI
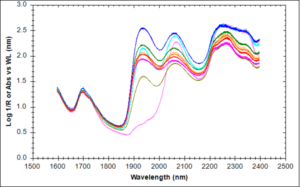
I principali picchi risultano essere:
– cannabinolo 1620, 1050, 1580, 1030, 1120 e 1228 cm·1
– cannabidiolo 1585, 1630, 1020, 121O, 1240 e 1050 cm·1
– Δ8-THC 1580, 1030, 1620, 1180, 1080 e 1260 cm·1
-.Δ.9-THC 1580, 1040, 1620, 1180, 1130 e 1050 cm·1
GASCROMATOGRAFIA CON RIVELATORE DI MASSA
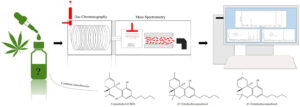
questi tre spettri sono rispettivamente cannabinolo,cannabidiolo e δ(8)-THC
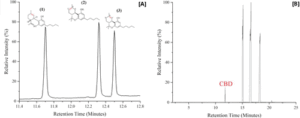
Figura 1. (A) Strutture di (1) CBD, RT 11,7 min; (2) Δ8-THC, RT 12,3 minuti; e (3) Δ9-THC, RT 12,5 min
visualizzati rispettivamente rispetto ai picchi GC. Il Δ8-THC ha un doppio legame tra gli atomi di carbonio
etichettati “a” e “b”, mentre il Δ9-THC ha un doppio legame tra gli atomi di carbonio etichettati “b” e “c”.
Il campione standard combinato è stato preparato mescolando volumi uguali di standard CBD, Δ8-THC e Δ9-THC
acquistati da Sigma-Aldrich Cerrelient Analytical Reference Standards e diluendo con metanolo. I picchi di CBD e Δ8-THC
vengono risolti con Rs = 11,2, mentre Δ8-THC e Δ9-THC vengono risolti con Rs = 3,5 (vedere le informazioni di supporto).
(B) Spettro GC dell'"estratto di canapa in olio di cocco MCT" di TN Homegrown. Il picco corrispondente al CBD è presente
a RT 11,7 min.
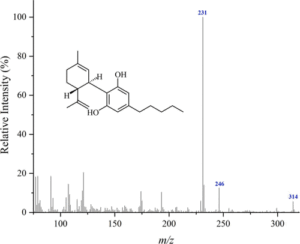
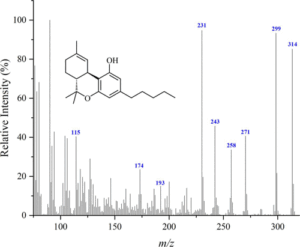
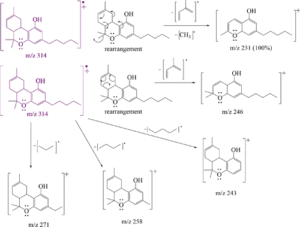
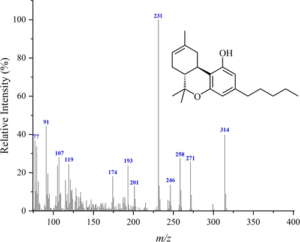
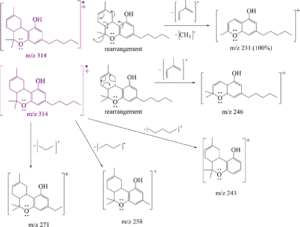
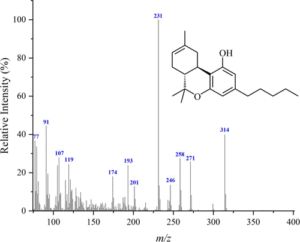
i picchi principali sono:
cannabidiolo: m/ z = 231, 246, 314, 232, 121, 193, 74 e 174
cannabinolo m/ z = 295, 296, 238, 31O, 119, 43, 251 e 239
Δ(8)-THC m/ z = 221, 314, 248, 261 , 193, 236 , 222 e 315
Δ(9)-THC: m/ z = 299, 231 , 314, 43, 41, 295, 55 e 271
ANALISI QUANTITATIVA
- A) Gas cromatografia
A- 1) colonna impaccata in isoterma senza derivatizzazione
strumentazione
- gascromatografo munito di rivelatore a ionizzazione di fiamma
- colonna cromatografica in vetro, 2,5 m x 3,2 mm, contenente metilfenilsilicone (tipo OV-17 al 3 %) su Gas Chrom Q, 100-120 mesh
reattivi
- cannabinoidi standard di riferimento
- etere di petrolio 40-65 °C o solvente di polarità vicina
- soluzione etanolica allo O,1 % p/ v di androstene-3 ,17-dione (standard interno)
procedimento
si pesano con accuratezza circa 50 mg di campione e si estraggono per due volte con 0-20 ml di etere di petrolio.Si fanno evaporare a secco le soluzioni e si riprende poiil re s duo con 10 ml di etere di petrolio.
Si preleva 1,0 ml di tale soluzione,si porta a secchezza e si riprende poi il residuo con 2,0 ml di soluzione etanolica allo 0,1 % di androstene-3,17-dione (st. int.) (con tempo di riten zione nettamente superiore a quello dei vari carotenoidi).
Alla stessa maniera si prepara una curva di calibrazione con soluzione di (9)-THC a concentrazioni da 0,10 a 1,5 mg di (9)-THC/ml di soluzione etanolica allo 0,1 % di androstene-3,17-dione.
Si inietta quindi 1,0 µI di ciascuna soluzione nelle seguenti condizioni operative:
- temperatura iniettore: 280 °C
- temperatura rivelatore: 270 °C
- temperatura colonna: 240 °C
- gas di trasporto: azoto, velocità di flusso 25 ml/min
- idrogeno, 25 ml/min
- aria, 300 ml/min
A-2) colonna impaccata a temperatura programmata con derivatizzazione
strumentazione
- gas cromatografo munito di rivelatore a ionizzazione di fiamma
- colonna cromatografica in vetro 2 m x 3 mm i. contenente SE 30 al 3 % su Gas Chrom Q, 100-120 mesh
Reattivi
- cannabinoidi standard di riferimento
- N,0-bis-(trimetilsilil)-trifluoroacetammide (BTMFA)
- n-tetracosano (o n-alcano a numero pari di atomi di carbonio) (standard interno)
Procedimento
Si pesano con esattezza circa 50 mg di campione e si estraggono per 2 volte con 1O mldi etere di petrolio. Si portano a secco gli estratti e si riprende il residuo con 1O ml di etere di petrolio.
Si preleva poi 1,0 ml di tale soluzione e si riporta a secchezza; si aggiungono 100 µIdi re attivo di silanizzazione e si riprende con 1,0 ml di soluzione di standard interno.
Si inietta quindi 1,0 µI di tale soluzione nel cromatografo nelle condizioni operative di se guito indicate:
- temperatura iniettore: 280 °C
- temperatura rivelatore: 270 °C
- temperatura colonna: programma di temperatura: da 100 a 320 °C, riscaldamento 4 °C/min
- gas di trasporto: azoto, velocità di flusso 30 ml/min
Di seguito sono indicati gli indici di ritenzione:
cannabiciclolo 2280 propilcannabidiolo 2110
cannabidiolo 2270 propil-Δ(9)-THC 2170
cannabigerolo 2440 Δ(9)-THC 2350
cannabinolo 2430
Analisi del contenuto di THC in un campione(infiorescenze) via curva di taratura
Il campione si presenta in forma di fiore secco. 249 mg venivano estratti con etanolo con la seguente metodologia :
vengono addizionati di 5 ml di Etanolo e tenuti sotto agitazione magnetica per 2 h ed ultrasuoni per 15’; segue una filtrazione.
Agli estratti in etanolo vengono aggiunti 12 mg (0,031 mmol) di Colesterolo e sotto agitazione e leggero riscaldamento (30-40°C) fino a sua solubilizzazione.
1 µl di tale soluzione viene quindi iniettato al GC/MS e si risale al rapporto delle Aree THC/Colesterolo e da questo al rapporto molare alla quantità di THC contenuto negli estratti.
Curva di taratura
Il metodo consiste nel preparare una serie di soluzioni standard utilizzando due componenti, di cui uno è il THC, l’altro invece è uno standard interno che deve obbedire a una serie di requisiti:
a. Non essere presente nella miscela da analizzare .
b. Essere ben risolto dagli altri componenti la miscela.
c. Avere un tR (tempo di ritenzione) vicino a quello della sostanza quantificare.
d. Non reagire con nessuno dei componenti dell’estratto
il colesterolo viene scelto per l’esecuzione della curva di taratura per una sua migliore solubilità e comportamento cromatografico.
Solitamente si preparano sei miscele THC/Colesterolo in differenti rapporti molari.
campione THC mmol Colesterolo”mmol
1 0,01 0,024
2 0,017 0,023
3 0,033 0,022
4 0,044 0,023
5 0,055 0,024
6 0,033 0,012
Lo strumento utilizzato preferibilmente è un Gas-cromatografo con rivelatore di massa GC-MS


