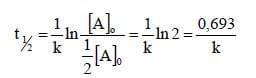 34= 0,693/k da cui k= 0,693/34 =0,0204Pertanto ln 100/12,5 =0,02 x t2,079 /0,0204=t t= 101,9= 102 s
34= 0,693/k da cui k= 0,693/34 =0,0204Pertanto ln 100/12,5 =0,02 x t2,079 /0,0204=t t= 101,9= 102 sGIOCHI DELLA CHIMICA REGIONALI CLASSE C 2017
Settembre 19, 2024+l) Indicare quali dei seguenti composti sono chirali e quali achirali:
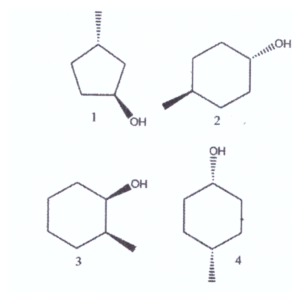
A) 1 e 2 sono chirali, 3 e 4 sono achirali
B) 2 e 4 sono chirali, 1 e 3 sono achirali
C) 2 e 4 sono achirali, 1 e 3 sono chirali
D) 1 e 4 sono achirali, 2 e 3 sono chirali
soluzione
sono chirali due molecole le cui strutture speculari non sono sovrapponibili l’un l’altra. Solo molecole che possiedono atomi asimmetrici (cioè che sono legati a 4 atomi o gruppi atomici diversi) possono essere chirali come per esempio

i due stereoisomeri (cioè molecole con atomi identici ma distribuzione spaziale diversa) sono definiti enantiomeri e possiedono la capacità di far ruotare un piano di luce polarizzata a destra o sinistra (isomeri ottici).
Tra le molecole sopra indicate vediamo che la n. 1 e la n.3 sono molecole asimmetriche e contengono un atomo di carbonio asimmetrico e sono pertanto chirali.
Le molecole n. 2 e n. 4 sono invece achirali in quanto presentano elementi di simmetria quali piani e centri e non possiedono atomi di carbonio asimmetrici.
la riposta corretta al quesito è C
2) La reazione acido-base dell’acetilene (pK= 25) con idruro di sodio produce acetiluro di sodio e idrogeno (pK=35). Sulla base dei pK riportati, calcolare la Keq della reazione.
![]() + Na++H–
+ Na++H– ![]()
![]()
A)10-10
B) 1010
C) 1060
D) 10-20
soluzione
poichè ![]() _
_ ![]()
![]() ha un PKa= 25 Ka= 10-25
ha un PKa= 25 Ka= 10-25
e per ![]() PKa= 35 Ka=10-35
PKa= 35 Ka=10-35
Keq= [![]() ] [ Na +] [H2] /
] [ Na +] [H2] /![]() ] [Na+][H– ]
] [Na+][H– ]
semplificando e ricordando che il numeratore di questa frazione è
PKa=25
ed il denominatore
PKa=35
essendo inoltre
PK= -log K
Ka= 10-PK
Keq = 10-25 / 10-35 = 1010
la risposta corretta è B
3) Grassi e oli sono trigliceridi, ossia triesteri del glicerolo con acidi grassi. Qual è la conseguenza della presenza di doppi legami, caratteristica degli oli?
A) Impedisce l’impacchettamento delle catene degli acidi grassi, diminuendo la viscosità degli oli
B) Conferisce agli oli una maggiore stabilità ad alte temperature
C) Favorisce l’impacchettamento delle catene degli acidi grassi, aumentando la vìscosità degli oli
D) Conferisce agli oli la tipica colorazione gialla
soluzione
I grassi sono definiti come miscele di trigliceridi misti cioè esteri del glicerolo (che contiene tre gruppi ossidrilici) con una vasta gamma di acidi grassi a catena lunga. I grassi formano il principale sottogruppo di un gruppo di esteri di acidi grassi conosciuti come lipidi, la definizione dei quali qualche volta si estende a includere altri composti grassi solubili. Le proprietà fisiche e chimiche dei singoli grassi sono determinate dai tipi e dalle proporzioni di acidi grassi che entrano nella composizione del trigliceride. I grassi sono costituiti essenzialmente da una miscela di trigliceridi che contengono acidi grassi saturi. Gli oli, invece,sono costituiti essenzialmente da una miscela di trigliceridi che contengono prevalentemente acidi grassi insaturi. Questi acidi, a seconda che la loro struttura sia CIS o TRANS conferiscono all’olio una diversa viscosità infatti se consideriamo i due acidi insaturi


vediamo che il primo dei due è l’acido oleico (CIS) mentre il secondo è l’acido elainidico(TRANS). E’ intuibile che la presenza del primo acido determini la difficoltà di impacchettamento delle catene di acido per motivi sterici e ciò ovviamente causa una diminuzione della viscosità degli oli rispetto ai grassi. La presenza degli acidi TRANS determina un buon impacchettamento delle molecole aumentando la viscosità degli oli.
la risposta corretta è A
4) Osservando i calori di idrogenazione dei seguenti alcheni, si deduce che gli alcheni diventano più stabili all’aumentare della sostituzione sul doppio legame. Quale tra le seguenti è la spiegazione più adeguata?
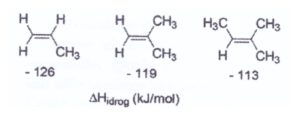
A) I gruppi alchilici stabilizzano gli alcheni mediante effetti elettronici
B) I gruppi alchilici stabilizzano gli alcheni aumentandone la simmetria
C) I gruppi alchilici stabilizzano gli alcheni aumentandone il carattere di triplo legame
D) I gruppi alchilici stabilizzano gli alcheni mediante effetti sterici
soluzione
Numerose evidenze sperimentali confermano che quando una molecola con un doppio legame reagisce con HX si sha una reazione di somma, il cui meccanismo porta alla formazione di un carbocatione,
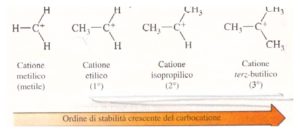
la distribuzione delle cariche permette di valutare la stabilità del carbocatione che si viene a formare
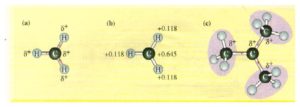
e si evidenzia che il gruppo metilico ha la funzione di orientare e facilitare l’apertura del doppio legame e naturalmente più gruppi metilici sono presenti nella molecola più stabile è il carbocatione che si forma e questo spiega anche la regola di Markovnikov che prevede che il gruppo negativo che deriva da HX (X-) si leghi al carbonio più sostituito che abbia cioè gruppi atomici al posto di ogni atomo di idrogeno. L’effetto dei metili è un effetto elettronico che si definisce effetto induttivo.
La risposta corretta è A
5) Le ammine aromatiche sono basi nettamente più deboli di quelle alifatiche. Scegliere la spiegazione più plausibile tra le seguenti:
A) l’anello aromatico esercita un effetto induttivo elettrondonatore sull’azoto
B) il doppietto elettronico sull’azoto è più disponibile alla reazione con un acido a causa della stabilizzazione per risonanza dell’ammina aromatica
C) il doppietto elettronico sull’azoto è meno disponibile alla reazione con un acido a causa della stabilizzazione per risonanza dell’ ammina aromatica
D) l’anello aromatico impedisce stericamente la reazione con un acido
soluzione
Possiamo considerare le ammine come derivati dell’ammoniaca, NH3 in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alifatici (alchilici) o aromatici (arilici). Una ammina è detta primaria se viene sostituito un solo idrogeno con un radicale alchilico (alifatico) o aromatico e si indica generalmente NH2R se alifatica o NH2Ar se aromatica. Si dice secondaria se si ha la sostituzione di 2 atomi di H dell’NH3 con R o Ar quindi si indica con NHR2,. Ovviamente un’ammina si dice terziaria quando presenta tre gruppi R legati all’azoto. Sappiamo inoltre, che l’azoto possiede un doppietto elettronico non impegnato in legami e nell’ammoniaca esso determina la sua basicità. E’ chiaro che se all’azoto sono legati gruppi elettrondonatori essi aumentano la densità elettronica sull’azoto e quindi la basicità aumenta. Tutti i gruppi elettronattrattori, invece, determinano una minore densità elettronica sull’azoto per cui ne diminuiscono la basicità.(Ricordiamo che un composto è basico quando cede elettroni e quindi se possiede maggiore carica elettronica da rendere disponibile alla cessione allora la sua basicità aumenta). Se consideriamo la metilamina CH3-NH2 vediamo che sia il C del CH3 che l’N dell’NH2 sono ibridi SP3 e sappiamo che CH3→ è un gruppo elettrondonatore per cui la basicità rispetto a quella di NH3 aumenta.
Tuttavia, se consideriamo il solo effetto elettrondonatore dei gruppi alchilici (effetto induttivo +I) le ammine terziarie dovrebbero essere le più basiche, ma non è così in quanto le ammine secondarie sono più basiche delle terziarie.
NH3 < ammine primarie ~ ammine terziarie < ammine secondarie
Ciò perché occorre considerare oltre all’effetto induttivo, anche l’ immpaccamento o effetto sterico dei gruppi legati all’azoto ed anche la solvatazione degli ioni .Infatti poichè la basicità consiste nel donare gli elettroni del doppietto dell’ azoto, e in soluzione acquosa è il protone dell’acqua a riceverli per formare uno ione positivo, ne consegue che il numero di gruppi alifatici legati all’azoto dell’ammina rendono più difficile a causa dell’impedimento sterico l’attacco dell’idrogeno dell’acqua al doppietto dell’azoto, pur avendo l’azoto una densità elettronica magggiore di NH3. Ne consegue che le ammine secondarie, pur aumentando la densità elettronica sull’azoto con minore entità rispetto alle ammine terziarie, a causa del minore effetto sterico sono più basiche delle terziarie. Non solo, ma lo ione che si forma viene stabilizzato non solo a causa dell’effetto induttivo dei gruppi alchilici ma anche dalla solvatazione con le molecole di acqua, infatti maggiore è la dimensione dello ione che si forma, tanto meno esso è stabilizzato. L ’effetto induttivo, l’impedimento sterico dei gruppi alchilici e la solvatazione dello ione che si forma competono tra loro tanto che, talvolta, è complicato prevedere l’ordine di basicità delle ammine.
Nelle ammine aromatiche l’anello aromatico si lega all’azoto con un carbonio ibrido SP2 per cui l’azoto che si ibridizza anch’esso SP2 delocalizza i due elettroni del doppietto formando una molecola stabile

questo comporta una minore disponibilità dell’azoto a donare all’H+ dell’acqua il doppietto elettronico.Ne consegue che le ammine aromatiche sono molto meno basiche delle ammine alifatiche.
Da quanto esposto la risposta corretta è C
6) Quale dei quattro composti è il prodotto finale della seguente serie di reazioni:

A) l
B) 2
C) 3
D) 4
soluzione
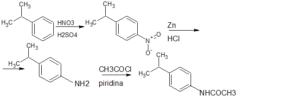
il gruppo isopropilico ha un effetto induttivo sull’anello benzenico ed orienta la reazione in Para e non in meta, Ciò significa che sia il composto 3 che il composto 4 non si possono formare . La formazione del composto numero 1 è impossibile a causa del fatto che il gruppo isopopropilico non può essere sostituito dal CH3CH2CO . Si deduce che il composto che si forma è il composto 2 : infatti, si ha inizialmente la nitrazione in para del benzene con HNO3 ed H2SO4 e succesiva riduzione di NO2 ad NH2 con Zn ed HCl . La successiva reazione con CH3COCl porta al composto 2 ed HCl.
risposta corretta B
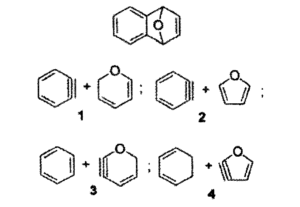
7- Individuare quale coppia di reagenti produrrà per riscaldamento il seguente addotto di Diels-Alders
A) l
B) 2
C) 3
D) 4
soluzione
Reazione di Diels-Alder avviene per sovrapposizione tra l’orbitale molecolare occupato a più alta energia (HOMO) di un reagente e l’orbitale vuoto a più bassa energia (LUMO) dell’altro ma solo se i lobi positivi e negativi di ciascun orbitale si sovrappongono.
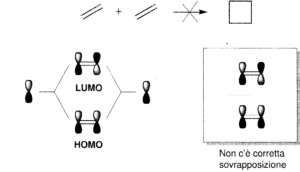
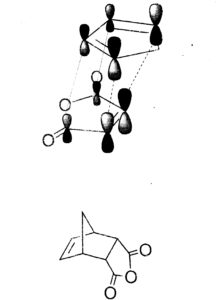
il furano ha 6 elettroni π delocalizzati e si comporta come un diene per cui:
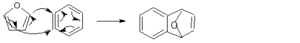
la risposta corretta è B
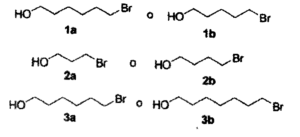
8- Le coppie di composti che seguono formano eteri ciclici per rimozione del protone alcolico con aggiunta di OH-(aq)’ reazione procede nel modo seguente Quale composto, in ciascuna coppia, formerà l’etere ciclico più rapidamente?
A) 1a,2a,3b
B) 1b,2b,3b
C)1b,2a,3a
D)1b,2b,3a
soluzione
la formazione di eteri ciclici da alcoli alogenati è chiamata sintesi di Williamson che l’ha effettuata nel 1851 e che viene indicata come intramolecolare.
Questa reazione avviene per deprotonazione dell’idrogeno legato all’OH per mezzo di una base e porta al successivo distacco dell’alogeno con formazione dell’etere ciclico e dell’ alogeno, che in questo caso è Br. La reazione avviene con un meccanismo SN2 e la velocità di reazione dipende dal tipo di anello che si forma infatti l’ordine di facilità di formazione degli anelli è
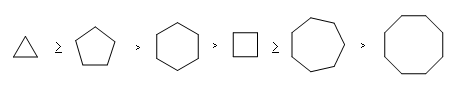
dipendendo dai contributi entalpici ed entropici della reazione. Pertanto i composti che di preferenza reagiscono nelle coppie fornite dal quesito sono:
il composto 3a reagisce preferenzialmente rispetto al 3b nel modo seguente
il composto 2b reagice preferenzialmente per formare
il composto 1b reagisce preferenzialmente rispetto ad 1a.
La risposta corretta è D
9- Individuare l’affermazione errata riguardo una reazione che può procedere secondo un percorso a controllo cinetico o a controllo termodinamico.
A)Il percorso a controllo cinetico prevede l’energia di attivazione più bassa
B)Il percorso a controllo termodinamico prevede la formazione del prodotto più stabile
C)Il percorso a controllo cinetico prevede l’energia di attivazione più alta
D)I due percorsi sono caratterizzati da differente energia di attivazione
soluzione
Se in una reazione si possono formare più prodotti ad esempio un prodotto A ed un prodotto B e consideriamo il diagramma della coordinata di reazione:

possiamo notare che l’energia di attivazione di A, che nel grafico è la curva con il massimo più basso e quindi con energia di attivazione più bassa, si forma più rapidamente di B e quindi A viene detto prodotto cinetico della reazione. Se osserviamo ancora, vediamo che il prodotto B finale è tuttavia energeticamente più stabile di A in quanto ha un’energia più bassa di A e viene detto prodotto termodinamico .
Quando una reazione forma il prodotto cinetico in quantità maggiore si dice che è sotto il controllo cinetico mentre se dà luogo in quantità maggiore al prodotto termodinamico si dice che è sotto il controllo termodinamico.
Da quanto espresso sopra, l’espressione errata è C in quanto l’energia di attivazione del prodotto cinetico è più bassa e non più alta.
10-La solfonazione del benzene è l’unica sostituzione elettrofila aromatica (SEAr) reversibile. Quale potrebbe essere il suo utile impiego in sintesi aromatica?
A) Come temporaneo gruppo attivante per successive reazioni di SEAr.
B) Per aumentare temporaneamente il punto di ebollizione del sistema aromatico.
C) Come gruppo protettore, mantenendo temporaneamente occupata una posizione dell’ ane Ilo.
D) Per conferire temporaneamente proprietà acide al sistema aromatico.
soluzione
mediante solfonazione si introduce in un composto organico uno o più gruppi solfonici -SO3H, derivanti dall’acido solforico. Il prodotto ottenuto è più solubile in acqua rispetto al composto di partenza.La solfonazione è molto utilizzata con i composti aromatici e la reazione è:

La reazione è reversibile e per idrolisi forma nuovamente i composti di partenza. Questa caratteristica è utilizzata per proteggere una posizione dell’ anello benzenico e successivamente introdurre altri gruppi funzionali nella stessa posizione in cui risiedeva il gruppo solfonico (es. gruppi nitro, nitroso, ossidrile).
da quanto esposto la risposta corretta è C
11-La reazione dell’ammoniaca con un cloruro acilico per la sintesi delle ammidi procede generalmente in presenza di una quantità doppia di NH3 rispetto al cloruro. Perché?
A) L’eccesso di ammoniaca fa aumentare il pH garantendo la stabilità dell’ammide formata
B) L’eccesso di ammoniaca serve a controbilanciare l’acido cloridrico generato nel corso della reazione
C) L’eccesso di ammoniaca serve per la cristallizzazione dell’ammide appena formata.
D) L’eccesso di ammoniaca fa diminuire il pH garantendo la stabilità dell’ammide formata
soluzione
La reazione in piridina è molto rapida e completa; normalmente si utilizza un eccesso di ammoniaca
la reazione tra ammoniaca e alogenuro acilico porta alla formazione dell’ammide:
RCOX + NH3 → RCONH2 + HX
Ad esempio il cloruro di acetile reagisce con NH3 secondo la reazione:
CH3COCl + NH3 → CH3CONH2 + HCl
La reazione viene condotta aggiungendo il cloruro di acetile ad una soluzione concentrata di ammoniaca.
L’ HCl prodotto dalla reazione reagisce con l’eccesso di ammoniaca per dare cloruro di ammonio per questo viene usata una quantità doppia di ammoniaca
NH3 + HCl → NH4Cl
La reazione complessiva che si ha, combinando la (1 e la (2 è quindi:
CH3COCl + 2 NH3 → CH3CONH2 + NH4Cl
La reazione che avviene in modo violento e con produzione di fumo bianco è una reazione di sostituzione nucleofila che avviene secondo il seguente meccanismo:

la reazione avviene in tre stadi:
Nel primo stadio il doppietto elettronico presente sull’azoto attacca il Carbonio carbonilico; si rompe il doppio legame carbonio ossigeno che si carica negativamente mentre l’azoto che ha condiviso il suo doppietto diventa carico positivamente.
Nel secondo stadio si ricostituisce il doppio legame del C=O e la carica negativa viene eliminata con il cloro come ione cloruro
Nel terzo stadio una molecola di ammoniaca rimuove un protone all’azoto e si forma l’ammide e l’NH4+ reagisce con Cl- per formare NH4Cl.
la risposta esatta al quesito è B
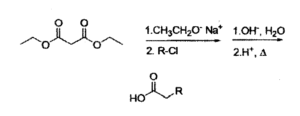
12) La sintesi malonica sfrutta l’alchilazione al carbonio in α e la decarbossilazione di un acido 1,3-dicarbossilico, ed è utilizzata per sintetizzare derivati dell’acido acetico secondo lo schema riportato.
Individuare i due cloruri alchilici (R-Cl) necessari per generare il composto:
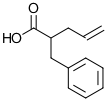
tramite lo schema proposto:
A) Clorobenzene e 1-cloro-1-propene
B) Cloruro di benzile e 3-cloropropene
C) Cloruro di benzile e 1-cloropropano
D) Clorobenzene e 3-cloropropene
soluzione
la reazione procede nel modo seguente:


questo composto perde successivamente CO2
Nel caso del quesito proposto, si osserva che R2 ed R1 sono rispettivamente
3 cloropropene e cloruro di benzile
 +
+  – CO2 ——–>
– CO2 ——–> 
R2 R1
risposta corretta B
13) Gli equilibri conformazionali per iI cis e il trans 3-fluorobromocicloesano sono riportati sotto. Scegliere l’affermazione esatta tra le seguenti:
A) i conformeri più stabili nelle rispettive coppie sono l’ l cis e il 2 trans
B) i conformeri più stabili nelle rispettive coppie sono l’ 1 cis e l’ 1 trans
C) i conformeri più stabili nelle rispettive coppie sono il 2 cis e l’ l trans
D) i conformeri nelle rispettive coppie hanno la stessa stabilità
soluzione
Sappiamo che i cicloalcani, diversi dal ciclopropano, non hanno conformazione planare ma assumono conformazioni tali che le tensioni dell’ anello siano ridotte al minimo.
Sappiamo inoltre che sono tre i fattori che producono le conformazioni a più bassa energia che determinano quindi la stabilità dei cicloalcani:
- Tensione angolare: la tensione che origina dalla deviazione dell’angolo di legame rispetto a quello tetraedrico
- Tensione di torsione: la tensione di rotazione causata dall’ eclissamento di legami C-H
- Tensione sterica: la tensione dovuta alla repulsione tra atomi vicini
Il cicloesano non è un cicloalcano planare ma assume una conformazione a sedia che è priva di tensione,perché gli angoli di legame C-C-C hanno struttura tetraedrica e tutti i legami C-H sono quindi sfalsati.
I sei legami assiali sono paralleli ed alternati in su e giu.
I legami equatoriali sono secondo linee parallele.
L’anello del cicloesano non è fisso e cambia la conformazione a temperatura ambiente e la conversione tra due conformazioni a sedia è detta inversione di anello.L a barriera di energia che separa le due conformazioni a sediaè di solo 10 kcal/mol per cui la conversione è molto rapida e troviamo ambedue le conformazioni all’equilibrio.
Le conformazioni a più bassa energia evidentemente sono:
nel primo equilibrio la conformazione 1 perchè nella 2 vi sono interazioni steriche tra Br ed F
nel secondo equilibrio la conformazione 2 in cui F e Br sono in posizioni opposte rispetto al piano e quindi in posizione priva di interazioni steriche
riposta corretta al quesito : A
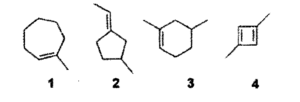
15) Un composto incognito si combina con un equivalente di H2 in una reazione in presenza di Ni come catalizzatore, e in un’altra genera, per addizione di HCl (aq) un composto achirale. Quale dei seguenti composti è quello incognito?
A) l
B) 2
C) 3
D) 4
soluzione
sono chirali due molecole le cui strutture speculari non sono sovrapponibili l’un l’altra. Solo molecole che possiedono atomi asimmetrici (cioè che sono legati a 4 atomi o gruppi atomici diversi) possono essere chirali come per esempio


i due stereoisomeri (cioè molecole con atomi identici ma distribuzione spaziale diversa) sono definiti enantiomeri e possiedono la capacità di far ruotare un piano di luce polarizzata a destra o sinistra (isomeri ottici). Nel caso in esame tra i composti
l’unica struttura che non contiene un carbonio chirale è la 1 quindi
risposta corretta A
16) La pressione osmotica di una soluzione ottenuta sciogliendo 0,400 g di polistirene in 100 cm3 di benzene, alla temperatura di 25,0°C è 1,5 kPa. Calcolare la massa molare (media) del polistirene.
A) 6,6 g mol-1
B) 66 kg mol-1
C) 6,6 kg mol-1
D) 660 kg mol-1
soluzione
La pressione osmotica è la differenza di pressione tra due soluzioni a diversa concentrazione separate da una membrana semipermeabile cioè che permette solo il passaggio del solvente.La pressione osmotica è la pressione che deve essere esercitata sulla sezione contenente la soluzione per impedire il passaggio del solvente dalla sezione contenente solvente puro a quella contenente la soluzione.Il sistema favorisce la diffusione delle molecole di solvente verso la soluzione, in modo da tendere all’uguaglianza dei potenziali chimici del solvente nelle due sezioni.

a sinistra vi è solo solvente e a destra soluto + solvente. Il solvente fluisce nella sezione contenente il soluto sino a quando si crea un dislivello tale che l’aumento di pressione idrostatica (atmosferica ) conseguente all’ingresso di solvente, contrasta la pressione osmotica.La pressione osmotica si indica con π ed ovviamente segue la legge dei Gas che in questo caso è la legge di Van’t Hoff. La pressione osmotica è una proprietà colligativa che dipende dalla quantità di particelle presenti in soluzione quindi
π V =nRT x i dove i è il coefficiente di Van’t Hoff cioè il numero di particelle (es.per NaCl i=2 per MgCl2 i=3 per il glucosio che non si scinde in soluzione si ha i=1 ).
quindi
π =1,5 kPa
n= 0,4g /PM moli di polistirene
V=100 cc di solvente
R=8,314
T= 298
pertanto 1,5 x 100 = 0,4/PM x 8,314 x 298
PM = 0,4 x 8314 x 298/ 1,5 x 100 = 991,028/ 150=6,6 Kg/mol
risposta corretta C
17) Per una certa reazione il ΔΗº risulta essere pari a 350 kJ mentre il ΔSº è -160 J K-1. Si può quindi affermare che in condizioni standard per questa reazione:
A) il valore della costante di equilibrio sarà maggiore di l
B) il valore della costante di equilibrio sarà inferiore a l
C) la costante di equilibrio avrà valore negativo
D) la costante di equilibrio sarà uguale a zero
soluzione
sappiamo che per una generica reazione A+B<=> C+D
se ΔG=0 la reazione è in equilibrio e l’ equilibrio viene espresso dal valore di
Keq= [C][D]/[A][B]
se Keq =1
i prodotti riformano i reagenti con la stessa velocità infatti il numeratore è uguale al denominatore
se Keq > 1
il numeratore è maggiore del denominatore quindi i prodotti si formano più velocemente riaspetto alla reazione inversa
se Keq < 1
i prodotti non si formano se non in quantità piccolissime.
La formula che, a pressione e temperatura costanti fornisce la quantità di energia libera rilasciata o assorbita dal sistema è:
- ΔG è la variazione di energia libera espressa in J
- ΔH è la variazione di entalpia , espressa in J;
- T è la Temperatura assoluta espressa in K;
- ΔS è la variazione di Entropia espressa in J/K;
all’equilibrio sappiamo che ΔG=0
sapendo che
Se ΔS<0 e ΔH>0, il processo non è mai spontaneo e Keq<1
Se ΔS>0 e ΔH<0, il processo è sempre spontaneo e Keq>1
Se ΔS>0 e ΔH>0, il processo è spontaneo solo ad alte temperature
Se ΔS<0 e ΔH<0, il processo è spontaneo solo a basse temperature
nel caso in esame ΔH =350 KJ e ΔS =-160 J/K per cui la reazione non è spontanea ed il numeratore è più piccolo del denominatore quindo K<1
la risposta corretta è B
18) A 500°C il ciclopropano si trasforma in propene. La reazione è del primo ordine con costante cinetica pari a 6,8 . 10-4 s-1. Se la concentrazione iniziale di ciclopropano è 0,25 mol dm3, quale sarà la sua concentrazione dopo 25 minuti?
A) 0,05 mol dm-3
B) 0,14 mol dm-3
C) 0.09 mol dm-3
D) 0,02 mol dm-3
soluzione
In una reazione del primo ordine la velocità dipende dalla concentrazione di uno solo dei reagenti e l’equazione che descrive la cinetica è:
v = – d[A]/dt = k [A]1= k[A] vedi il grafico e l’unità di misura di k è s-1 (secondi a meno1)
all’aumentare della concentrazione di A aumenta proporzionalmente la velocità.

o per meglio dire man mano che trascorre il tempo, la concentrazione di A diminuisce

Se il reagente A man mano diminuisce si ha :
![{\displaystyle {\frac {d\left[A\right]}{dt}}=-k\left[A\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d99a1a854d8fafe83bd0a7d184c46c974480f72e)
![{\displaystyle {\frac {d\left[A\right]}{\left[A\right]}}=-kdt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad717b48d29c475014081be49e9bff97020cf393)
integrando fra t=0 e t avremo: ![{\displaystyle \int _{\left[A\right]_{0}}^{\left[A\right]}{\frac {d\left[A\right]}{\left[A\right]}}=-k\int _{0}^{t}dt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18a7abc57fc770db6bf467aaf58c793c3ddf9b12)
![{\displaystyle \left[A\right]=\left[A\right]_{0}e^{-kt}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a505680e73f178880ded3e4e783053cad71140f)
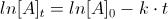 da cui
da cui
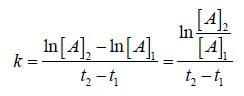
ln[A]2 = -kt + ln[A]1
nel caso in esame [A]1= 0,25 K=6,8 x 10-4 Δt= 25
ln[A] = -kt + ln[Ao] ln[A] =- 6,8 x 10-4 x 25 x 60 + ln 0,25 = – 1,02 -1,386 = = -2,3406 da cui si ottiene [A]2 = e-2,3406
[A]2= 0,09 mol /dm3
19) L’entalpia standard di combustione del saccarosio (C12H22O11) è -5645 kJ /mol, mentre quella dell’acido lattico (C3H6O3) è -1362 kJ mol'”. Quale sarà l’entalpia della reazione d’idrolisi anaerobica del saccarosio che diventa acido lattico?
A) -1559 kJ mol-1
B) -1559 Kj g-1
C) -197 kJ mol-1
D) 1559 kJ mol-1
soluzione
la reazione di decomposizione del saccarosio in acido lattico è
C12H22O11 + H2O —–> 4 C3H6O3
essendo ΔΗ reaz = ∑Ηprodotti – ∑ Ηreagenti
allora per la legge di Hess ΔΗ reaz = 4 Hcomb prod – Hcomb reag
pertanto ΔΗ reaz = 4 x -1362 – 5645 = 5448 – 5645 = – 197 kJ/mol
20) Per la reazione
NH4+(aq) + NO2–(aq) → N2(g) + 2H2O(l)
si conducono a 25°C due misure di velocità iniziale, r°, variando le concentrazioni iniziali [C]°.
I° esperimento:
[NH4+]°= 0,12 mol dm-3;
[NO2–]°= 0,10 mol dm-3 e
r° = 3,6 . 10-6 mol dm-3 s-1.
II°esperimento
[NH4+]°= 0,12 mol dm-3
[NO2-]° = 0,15 mol dm-3
r°= 5,4 . 1o-6 mol dm-3 s-1.
Se la reazione è del primo ordine rispetto a NH4 +, quale sarà l’ordine di reazione totale e il valore della costante cinetica?
A) La reazione è del secondo ordine k = 3,00 . 10-4 dm3 mol-1 s-1
B) La reazione è del primo ordine k= 5,00 . 10-4 dm3 mol-1 s-1
C) La reazione è del primo ordine k = 3 00 . 10-4 dm3 mol-1 s-1
D) La reazione è del secondo ordine; k =: 5,00 . 10-4 dm3 mol-1 s-1
soluzione
in linea di principio, per stabilire l’ordine di una reazione si scrivono le equazione cinetiche prima di una reazione ordine 0:
v=C2-C1/t2-t1
poi si scrive quella del primo ordine
(1/t2-t1 )ln C1/C2 =k
poi quella di secondo ordine :
1/[A] – 1/[A°] = kT
le cinetiche di ordine 0 e 1, danno luogo ad un grafico lineare (per la cinetica di ordine 1 si usa un diagramma semilogaritmico (logaritmo delle concentrazioni in funzione del tempo);
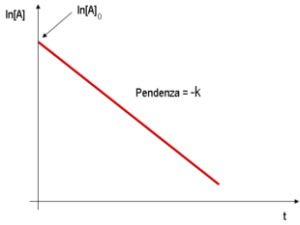
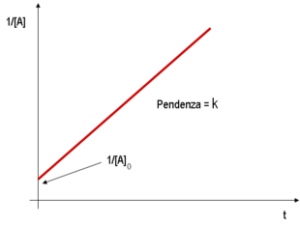
nel caso del quesito, si osserva che mantenendo costante la [NH4+] e facendo variare la [NO2-] la velocità varia e quindi la reazione non può essere di ordine zero relativamente ad [NO2-].
Poichè la velocità aumenta linearmente con la [NO2-] la reazione è quindi del primo ordine rispetto ad NO2-.
La reazione globale è pertanto di secondo ordine infatti [NH4+]1 [NO2-]1
Per calcolare il valore di k applichiamo la relazione della cinetica del secondo ordine :
r=k[NH4+][NO2-]
5,4 x 10-6 =k 0,12 x 0,15 K= 5,4 x 10-6/ 0,018 =3,00 x 10-4
oppure
3,6 x 10-6 /0,12 x 0,1 =k
k= 3,6 x 10-6/0,012 = 3,00 x 10-4
21) Se temperatura, pressione e numero di moli di ogni componente di un sistema non cambiano, un processo è spontaneo se:
A) l’energia interna del sistema diminuisce
B) l’entropia del sistema aumenta
C) l’energia di Gibbs del sistema diminuisce
D) l’energia interna dell’ambiente diminuisce
soluzione
In natura esistono processi spontanei e processi non spontanei.
il passaggio di calore da un corpo più caldo a un corpo meno caldo (o più freddo)è un processo spontaneo così come l’espansione di un gas mentre i processi inversi ovviamente non sono spontanei così come non è spontanea la scomposizione dell’acqua nei suoi elementi idrogeno ed ossigeno. Nei processi spontanei il sistema cede energia all’ambiente mentre un processo non spontaneo può avvenire solo se gli si fornisce energia dall’esterno. Ma quali sono i fattori implicati in un processo spontaneo?
Nei processi spontanei solitamente il sistema diminuisce la propria energia cedendola all’ambiente (ad esempio una reazione esotermica ΔΗ<0) ma non tutte le trasformazioni esotermiche sono spontanee ed inoltre si osserva che alcune trasformazioni endotermiche (in cui Δ H > 0) sono invece spontanee.La variazione di entalpia, pertanto,non è il solo fattore che è alla base della spontaneità di un processo. questa infatti, dipende anche dalla possibilità che un sistema si trasformi in uno stato di maggiore disordine.Il grado di disordine di un sistema è quantitativamente espresso dalla entropia funzione di stato termodinamica (simbolo, S), che è calcolabile dalla seguente relazione (principio di Boltzmann):

dove K è la costante di Boltzmann e W rappresenta la probabilità che un dato stato del sistema in esame ha di verificarsi.Matematicamente, la variazione di entropia (ΔS) è definita da:

dove Qrev è la quantità di calore scambiata da un sistema reversibilmente con l’ambiente e T è la temperatura assoluta del sistema. /reversibile è uno stato che differisce da quello successivo solo di un infinitesimo).
Quello scritto sopra è il secondo principio della termodinamica che si può riscrivere

cioè la variazione totale di entropia (Δ Stotale) è maggiore di zero nelle trasformazioni spontanee e uguale a zero nelle trasformazioni reversibili.
Per un sistema chimico, Δ S è :
ΔS=ΔSprodotti – ΔSreagenti
nelle trasformazioni spontanee a una data temperatura, la variazione di entropia del sistema è maggiore del rapporto fra calore e temperatura assoluta.
Tra energia libera ed entropia di un sistema vi è la seguente relazione:
che ci dice che non tutto il calore (ΔΗ) può fornire l’energia disponibile (energia libera) in quanto la parte TΔS serve al sistema stesso per la propria energia interna e non è disponi bile per la produzione di lavoro.
Un sistema isotermo a pressione costante e senza variazione del numero di moli è un sistema spontaneo solo se aumenta il disordine e quindi solo se TΔS è maggiore di ΔΗ in modo che ΔG sia negativo quindi < 0.
Pertanto anche se in generale un processo è spontaneo se aumenta l’entropia, un sistema come quello descritto nel quesito a P=k e T=k ed n=k è necessario che TΔS sia maggiore di ΔΗ in modo che ΔG<0.
La riposta corretta è quindi C
22) Una macchina termica lavora secondo un ciclo di Carnot. Assorbe il calore Qx dal serbatoio termico a temperatura Tx cede il calore Qy al serbatoio termico a temperatura Ty producendo il lavoro W. Indicare quale dei seguenti insiemi di valori è l’unico compatibile con il funzionamento della macchina
A) Qx = 2500J ; Tx = 304°C ; Qy = 1250 J ; Ty=15°C ; W=1250 J
B) Qx =2500 J; Tx= 15″C; Qy = 1250 J; Ty= 304°C; W=-1250J
C) Qx = 2500J; Tx = 304°C; Qy = -1250J; Ty= 15°C; W= +2500J
D) Qx= 2500 J; Tx = 304°C; Qy =-1250 J; Ty= 15°C; W = -1250 J
soluzione
Una macchina termica è un dispositivo in grado di scambiare calore e lavoro con l’ambiente circostante o altri sistemi fisici utilizzando una successione di trasformazioni termodinamiche che alla fine riportano il sistema al suo stato iniziale (ciclo termodinamico).. Il nome di una macchina termica di solito è quello del ciclo termodinamico associato e la macchina termica viene spesso chiamata motore .
Il lavoro è prodotto da una macchina termica utilizzando mediante gradiente termico tra una sorgente calda e una sorgente fredda. Il calore è trasferito dalla sorgente calda a quella fredda di solito tramite un fluido come ad esempio nel frigorifero.
Il fluido utilizzato può cambiare fase (macchina a cambiamento di fase), il fluido può essere un gas (motori a gas) oppure un liquido (motori a liquido) o può utilizzare gli elettroni (motore elettrico) o i campi magnetici (motore magnetico).
Il ciclo di Carnot utilizza due sorgenti termiche T1 e T2 (T1>T2) ed è costituito da 4 trasformazioni reversibili che sono : 2 isoterme (a temperatura costante) e 2 adiabatiche (senza scambio di calore con l’esterno). Il grafico Pressione / volume rappresenta visivamente il ciclo:
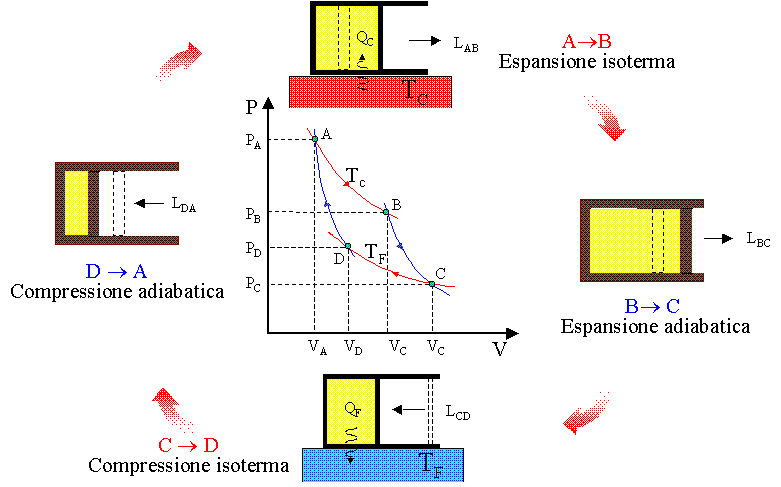
il gas preleva la quantità di calore Q1 dalla sorgente più calda T1 e questo provoca l’aumento di volume del gas e la diminuzione della pressione. La temperatura del gas tende quindi ad abbassarsi ma l’effetto sorgente termica compensa la diminuzione per cui la temperatura rimane costante (nel grafico il processo isotermo è indicato dai punti A B ). In questo processo viene prodotto Lavoro.
In una espansione isoterma, Q – L = Δ E; ma per un gas ideale a T=k ΔE=0, quindi Q = L
il lavoro di una isoterma è dato da:
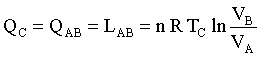
Quando il gas finisce di prelevare energia termica, esso viene mantenuto in modo che non scambi energia con l’esterno (processo adiabatico) , ma continua ad espandersi e questa espansione provoca un abbassamento della temperatura.(nel grafico i processo è indicato con B-C).
In una espansione adiabatica, Q – L = ΔE, Q = 0, quindi L = -ΔE
Il lavoro è calcolabile da:
,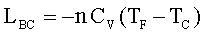
Il gas viene poi compresso mantenendo costante la temperatura e il calore generato dal lavoro compiuto (L= +PΔV) in questa fase viene rimosso dal contatto con la sorgente a temperatura più bassa T2<T1 e quindi il gas cede alla sorgente la quantità di calore Q2.(nel grafico il processo è indicato con C-D). Il lavoro quindi è:
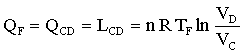
Quando il gas finisce di cedere calore alla sorgente, esso continua a comprimersi ma viene mantenuto in modo che non scambi calore con l’esterno.(fase D-A).Il lavoro è pertanto:
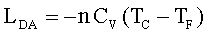
abbiamo pertanto per le due adiabatiche 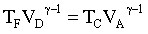
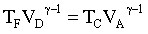 da cui
da cui
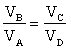
il lavoro totale del ciclo è:
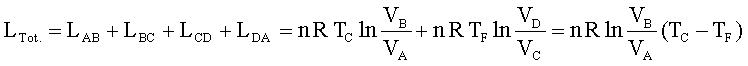
da cui si ha
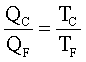
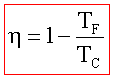
In conclusione il ciclo di Carnot dimostra che utilizzando un gas ideale e due sorgenti di temperatura si può creare una macchina(ideale) che produce lavoro riportando il gas nelle condizioni iniziali per ricominciare il ciclo.
Dall’ultima espressione si evince che il rendimento della macchina non può mai essere del 100% essendo η sempre minore di 1.
Dai dati del quesito si osserva che la risposta A è errata in quanto il lavoro W deve assumere segno negativo essendo effettuato dal sistema
La risposta B è anch’essa errata in quanto la temperatura Tx deve essere superiore a Ty
La risposta C è errata perché anche qui il lavoro è positivo
Si deduce che la riposta corretta è D
23) Indicare qual è la densità di un campione di metano chiuso in un contenitore a 30°C e alla pressione di 95 kPa:
A) circa 600 g m-3
B) circa 400 g m-3
C) circa 200 g m-3
D) circa 100 g m-3
soluzione
sappiamo che densità= massa /Volume
sappiamo anche che per un gas
PV=nRT da cui n/V=densità= P/RT ma n= massa/PM per cui
p/ RT = n/V = d/PM e quindi d = pM/RT
pertanto essendo 95 kPa=95000 Pa e PM=16 si ha
95000 x 16 / 8,314 x 303=1520000/ 2519,14= 603,3 g/m3
risposta corretta A
24) A temperature di poco inferiori a quella del punto triplo quale sequenza di transizioni si può osservare nel corso di una compressione isoterma dell’acqua?
A) Nell’ordine, da gas a solido e da solido a liquido
B) Nell’ordine, da gas a liquido e da Iiquìdo a solido
C) Da gas a liquido; non è possibile la transizione a solido
D) Da gas a solido; non è possibile la transizione a liquido
soluzione
Il punto triplo è un particolare stato, che dipende dai valori di Temperatura e Pressione, in cui coesistono in condizioni di equilibrio le fasi solido,liquido,aeriforme di una sostanza.

dal grafico si evince che a temperatura leggermente inferiore al punto triplo, per esempio a t=0 ,l’aumento di pressione comporta la trasformazione del gas allo stato solido e proseguendo con la compressione lo stato solido si trasforma in liquido.
La risposta corretta è A
25) Un corpo di ferro di massa 110 g, inizialmente a 95°C, viene immerso in 0,400 kg di acqua a 22,0°C. Quale temperatura viene raggiunta all’equilibrio?
La capacità termica del ferro è 0,450 J K-1 g-1 e quella dell’acqua è 4,184J K-1 g-1.
A) 34°C
B) 24°C
C) 44°C
D) 54°C
soluzione
Quando un corpo di massa m1, alla temperatura T1, viene messo in contatto termico con un altro corpo di massa m2, alla temperatura T2 diversa da T1, ha luogo un passaggio di calore dal corpo a temperatura più alta a quello a temperatura più bassa. Il flusso di calore termina non appena i due corpi hanno la stessa temperatura T0, cioè hanno raggiunto l’equilibrio termico. Se non vi sono perdite di calore nell’ ambiente esterno,(sistema adiabatico) tutto il calore ceduto dal corpo più caldo viene assorbito da quello più freddo. In questo caso la temperatura T0 di equilibrio risulta
![]()
dove c1 e c2 sono i calori specifici dei due corpi.
110 x 0,450 x 95 + 400 x 4,184 x 22 / 110 x 0,450 + 400 x 4,184 = Teq
4702.5 + 36819/1722,5 =24,1°C
risposta corretta B
26) La decomposizione termica della fosfina,PH3 secondo la reazione:
PH3 (g) → 1/4 P4 (g) + 3/2 H2 (g)
segue una cinetica del primo ordine e a 680°C il tempo di dimezzamento è 34 s. Calcolare il tempo richiesto per decomporre l’ 87,5 % della fosfina.
A) 96 s
B) 56 s
C) 84 s
D) 102 s
soluzione
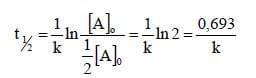 34= 0,693/k da cui k= 0,693/34 =0,0204Pertanto ln 100/12,5 =0,02 x t2,079 /0,0204=t t= 101,9= 102 s
34= 0,693/k da cui k= 0,693/34 =0,0204Pertanto ln 100/12,5 =0,02 x t2,079 /0,0204=t t= 101,9= 102 s27) Sperimentalmente si è trovato che la legge cinetica per la reazione:
2NO2(g) + F2(g),→2NO2F(g)
è r= k [NO2][F2].
E’ stato proposto, quindi, il seguente meccanismo di reazione:
1. NO2(g) + F2(g) → NO2F(g) + F(g)
2. NO2(g) + F(g)→ NO2F (g)
Tale meccanismo è compatibile con la legge cinetica se:
A) la reazione 1 è molto più lenta della 2
B) in nessun caso
C) le due reazioni hanno velocità comparabile
D) la reazione 2 in quella della 1
soluzione
Le reazioni possono avvenire in un solo stadio o in più stadi, che possono coinvolgere dissociazioni di molecole, trasferimenti di atomi, riarrangiamenti strutturali, trasferimenti di elettroni ecc. L’insieme di questi stadi o processi elementari è detto meccanismo di reazione. L’equazione cinetica in questi casi generalmente non corrisponde alla stechiometria della reazione, e nel caso specifico la cinetica non corrisponde alla reazione:
2NO2(g) + F2(g),→2NO2F(g)
infatti sperimentalmente si osserva che v = k [NO2][F2] e non v = k [NO2]2[F2]
Il meccanismo è:
NO2(g) + F2(g) = NO2F(g) + F(g) k1, stadio lento
F(g) + NO2(g) = NO2F(g) k2, stadio veloce
Lo stadio lento ha equazione cinetica: v = k1 [NO2][F2] che di fatto è la legge cinetica della
reazione complessiva perché la velocità della reazione 2 che è veloce, dipende dalla velocità della reazione 1 che è lenta.
La cinetica globale è quindi del secondo ordine ed il meccanismo proposto rivela che la reazione 1 è molto più lenta della 2 perché in realtà la reazione procede con l’attacco al doppietto elettronico dell’azoto per formare un legame risonante in NO2 , stabilizzando così la molecola con un guadagno di 18 kcal.

la risposta corretta è A
28) La pressione osmotica di una soluzione acquosa, alla temperatura di 288,0 K, è 140,0 kPa. Sapendo che la costante crioscopica dell’acqua è 1,86 K kg/ mol, quale sarà l’abbassamento del punto di congelamento della soluzione?
A) o,8°C
B) o,5°C
C) 0,1°C
D) 2,0° C
soluzione
La pressione osmotica e l’abbassamento del punto di congelamento o l’innalzamento del punto di ebollizione come l’abbassamento della tensione di vapore sono proprietà colligative delle soluzioni e dipendono dal numero e non della natura delle particelle di soluto che le compongono.
Quando un soluto è aggiunto ad un solvente, la soluzione così ottenuta congela ad una temperatura inferiore a quella del solvente puro
ΔT=K x m
dove k è la costante crioscopica del solvente
m è la molalità della soluzione ( moli su Kg solvente).
Si usa la molalità invece della molarità, perché la molalità non dipende dal volume, che dipende a sua volta dalla temperatura.
Per calcolare ΔT dalla ΔT=k m occorre conoscere m e questo è possibile dai dati di pressione osmotica. Infatti
π = C RT quindi C= π / RT
140000/8,314 x 288 =C
C= 58,5 quindi essendo K=1,86 K Kg mole-1
ΔT=k m ΔT=0,00186 x 58,5= 0,1°C
risposta corretta C
29) Due sostanze, A e B, presentano un’ampia laeuna di miscibilità in fase liquida. All’aumentare della temperatura, la loro miscela forma un azeotropo eterogeneo. Quindi:
A) una fase liquida sarà in equilibrio con una fase vapore più ricca nel componente più volatile •
B) due fasi liquide saranno in equilibrio con una fase vapore di composizione intermedia
C) una fase liquida sarà in equilibrio con una fase vapore più ricca nel componente meno volatile
D) due fasi liquide saranno in equilibrio con una terza fase liquida di composizione intermedia
soluzione
Miscela azeotropica è una miscela di due o più liquidi che non variano la propria composizione per semplice distillazione.Un azeotropo si forma quando tra le molecole delle due o più sostanze che lo compongono si manifestano fenomeni di attrazione o repulsione dovuti alla formazione di legami intermolecolari; a causa di tali legami il comportamento della miscela si discosta dalle condizioni ideali definite dalla legge di Raoult. All’ azeotropo eterogeneo si ha l’equilibrio di tre fasi: una fase vapore e due fasi liquide.
Secondo la regola delle fasi di Gibbs i gradi di libertà del sistema sono:
GL=2-F+N
Abbiamo N=2 specie chimiche e F=3 fasi quindi GL=1 cioè l’azeotropo eterogeneo dipende solo da T o da P. Nel caso del quesito la risposta corretta è che all’aumentare di T le due fasi liquide saranno in equilibrio con una fase vapore di composizione intermedia.
Risposta corretta B
30) A pressione atmosferica, un campione di glucosio fonde a 149°C, con una corrispondente variazione entalpica di 182 J/g. Qual è l’entropia di fusione del glucosio a questa temperatura?
A)-78 cal mol-1 K-1
B) 78 J mol-1 K-1
C) 78 kcal mol-1 K-1
D) 78 J g-1 K-1
soluzione
Quando una sostanza fonde si ha un incremento di entropia chiamato entropia di fusione. Questo valore è sempre positivo dato che l’entropia, che rappresenta la misura del disordine di una sostanza, aumenta nella transizione di fase da uno stato cristallino solido a una struttura disorganizzata liquida.Si indica con ΔSfus e le unità di misura sono J/mol K
l’espressione matematica che lega ΔH, T e ΔS è :
da cui si calcola ΔS ΔS= ΔH/T 182/149+273 = 182/422= 0,4313 J/g K
ma il glucosio pesa 180,12 grammi quindi ΔS= 0,4313 x 180,12= 77,7=78 J mol-1 k-1
risposta corretta B
31) Calcolare la percentuale (peso/volume) di H2O2 in una sua soluzione commerciale a 15,0 volumi. Si ricordi che da 1,00 L di soluzione di H2O2 a 1,00 volume si sviluppa 1,00L di O2 misurato a 273 K e 1,01 . 105 Pa.
A) 7,21%
B) 4,56%
C) 2,34%
D) 6,98%
soluzione
la decomposizione dell’acqua ossigenata è:
2 H2O2 → 2 H2O + O2
il PM H2O2=34,014
si osserva che dalla decomposizione di 2 moli di acqua ossigenata si ottengono 2 moli di acqua e 1 mole di ossigeno molecolare.
La massa di acqua ossigenata corrispondente a due moli è data da:
massa di acqua ossigenata = 2 mol x 34.014 g/mol = 68.03 g
Da 68.03 g di acqua ossigenata si ottiene quindi 1 mole di ossigeno che nelle condizioni standard ovvero alla temperatura di 273 K e alla pressione di 1 atm corrisponde a un volume di 22.4 L ( 1 mole di un qualunque gas a c.n. occupa sempre un volume di 22,4 litri)
Una concentrazione pari a 15 volumi significa che un 1 L di soluzione sviluppa 15 L di O2 che corrispondono a 15 / 22.4 = 0,67 moli di O2
Moli di acqua ossigenata = 0,67 mol x 2 = 1,34
Massa di acqua ossigenata = 1,34 mol x 34.014 g/mol =45,58 g
La massa di acqua ossigenata che dà 15 volumi di ossigeno è quindi 45,58 g
La concentrazione espressa in g/L è quindi 45,58 g/L
la % peso /volume è calcolata da 1000:45,51 =100 😡 X= 4558/1000= 4,56%
risposta corretta B
32) Il pH di una soluzione acquosa satura dell’acetato di un metallo, MAc(s) è 8,0. Determinare la solubilità del sale MAc(s) in acqua (si consideri solo la reazione dello ione Ac- in acqua trascurando tutti gli altri equilibri acido-base.
A) 6,1 x 10-6 M
B) 1,8 x 10-3 M
C) 4,2 x 10-7 M
D) 8,7 x 10-5 M
soluzione
sappiamo che se un sale AcM viene sciolto in acqua si formano gli ioni AC- ed M+ ed Ac- reagisce con H2O secondo la reazione
Ac- +H2O<==>AcH +OH- da cui Kidrolisi = [AcH][OH-] / [Ac] [H2O]
[H2O]= k pertanto Kidrolisi = [AcH][OH-] / [Ac]
sapendo che PH =8 allora POH=14-8 = 6 quindi [OH-]= 10 -6M
Ki = [OH-]2 / Cs ma Ki=Kw/Ka perciò sndo Ka CH3COOH = 1,8 x 10-5
allora si ha [OH-]² =Cs 10-14/1,8 x 10-5
possiamo calcolare Cs= (10-6)² x 1,8x 10-5 /10-14 = 10-12 x 1,8x 10-5/10-14
Cs= 1,8 x 10-17 / 10-14 = 1,8 x 10 -3
questa concentrazione rappresenta la solubilità del sale perché è quella che si ritrova nella soluzione sopra il corpo di fondo.
risposta corretta B
33) Una soluzione di un acido debole HY ha un pH = 4,90. Quante volte occorre diluire la soluzione per avere un pH =5,25?
A 10 volte
B 12 volte
C) 5 volte
D) 8 volte
soluzione
trattandosi di un acido debole, sappiamo che HA <==>H+ + A-
Ka=[H+][A-]/[HA]
[H+]² =Ka Ca pertanto nel primo caso
(1 x 10 -4,9 )2 = Ka Ca1 e nel secondo
(1 x 10-5,25)² =Ka Ca2 dividendo si ha
(1 x 10 -4,9 )2 /(1 x 10-5,25)² = Ca1/Ca2
1,59 x 10-10 / 3,12 x 10 -11 =Ca1/Ca2
Ca1/Ca2 = 0,5 x 10-1
Ca1/Ca2 = 5
pertanto l’acido deve essere diluito 5 volte
34 ANNULLATO
35 Calcolare la costante di equilibrio della reazione che si verifica aggiungendo polvere di Cu (s) ad una soluzione di H2SO4 5 M, conoscendo i valori di E° per le reazioni che seguono ed assumendo la pressione di SO2 (g) uguale a 1,01 x 105Pa:
S042-(aq) +4H+(aq) + 2e- → S02(g) + 2H20(l) E°1= 0,200 V
Cu2+(aq) + 2e- → Cu(s) E°2 = 0,337
A) 7,2 -10-6
B) 9,5 .10-5
C) 7,4 -10-4
D) 2,3x 10–5
soluzione
la reazione è
Cu(s) + H2SO4 → CuSO4 +2H+
la reazione da considerare per il rame solido è
Cu(s)→ Cu+2 +2e E° = – 0,337 V mentre la reazione dell’acido solforico è
S042-(aq) +4H+(aq) + 2e- → S02(g) + 2H20(l) E°= 0,337V
Cu+2 +SO4-2 +4H+ → Cu+2 + SO2 + 2H2O
E°cella= -0,337 + 0,2 = – 0,137 V
sappiamo che all’equilibrio ΔE cella =0 perciò ΔΕ° = E°cell= 0,059/2 lg K
-0,137 = 0,0295 log K log K = -0,137/0,0295= – 4,64
K=10-4,64
K= 2,29 x 10-5
risposta corretta D
36 I risultati dell’analisi elementare di una sostanza, espressi come percentuali in peso sono:
carbonio: 67,28%, idrogeno: 4,71 %, azoto: 13,08% e ossigeno: 14,94%. indicare qual è la formula bruta del composto:
A ) C6H6N02 B) C6H6N202 C) C6H6N20 D) C6HsNO
soluzione
dividiamo la % per rispettivo peso atomico
C=67,28/12= 5,6
H=4,71/1= 4,71
N= 13,08 /14 = o,94
O= 14,94/16=0,94
dividiamo per il numero più piccolo 0,94 ed avremo :
C= 5,6/0,94=6
H=4,71/0,94=5
N=0,94/0,94=1
O= 0,9470,94=1
ne consegue che la formula bruta è C6H5NO
37- In un recipiente chiuso a 430°C, idrogeno e iodio reagiscono, secondo la reazione:
H2(g) + I2(g) →2HI(g)
Mettendo a reagire quantità equimolari di idrogeno e iodio, all’equilibrio la pressione parziale dell’HI è il 78,65% della pressione totale. Calcolare la costante di equilibrio della reazione a 430°C .
A) 5430
B) 543
C) 54,3
D) 0,543
soluzione
la costante di equilibrio Kp per la reazione H2+I2→ 2HI è Kp = P2HI/ PI2 PH2
La presssione totale è : Pt = PHI + PI2 + PH2
Se la Pt=100 ed essendo PHI = 78,65
le pressioni parziali di PH2+PI2 = 100- 78,65 = 21,35 quindi
essendo H2 ed I2 in quantità equimolari allora PH2=PI2 = 21,35/2
P2HI=(78,65)2
PH2=PI2 = 21,35/2 = 10.67
sostituendo questi valori nell’espressione che fornisce Kp si ha:
Kp= 6185.8 /10,67 x 10,67= 6185,9/113,8 = 54,3
risposta corretta C
38) Un razzo con un motore che utilizza la reazione esotermica:
H2 + O2→H2O
deve portare un vettore aerospaziale a una altezza di 350 km.In questo percorso si producono 1,80x 106 kg di H2O. Determinare il consumo medio di idrogeno per ogni kilometro percorso dal razzo:
A) 571 kg ; B) 5710 kg C) 286 kg D) 2860 kg
soluzione
Dalla reazione sopra indicata
per 18 Kg di acqua che si formano si consumano 2 kg di idrogeno quindi se si formano 1,8 x 106 kg di H2O si saranno consumati
18:2 =1,8 x 106 : X X = 3,6 x 102 /18 =0,2 x 106 kg
se per 350Km si consumano 0,2 x 106 Kg per 1 Km si consumano X Kg di H
0,2 x 106 /350 =0,0005714 x 106 Kg = 5,71 x 102 Kg = 571 Kg
risposta corretta A
39) In un recipiente cilindro/pistone si stabilisce l’equilibrio:
CO (g)+ H2O(g) <==>CO2(g) +H2(g)
Che cosa accadrebbe, all’equilibrio, se aumentasse la pressione del sistema :
A) aumenterebbe la massa dei prodotti
B) aumenterebbe la massa dei reagenti
C) aumenterebbe la costante dì equìlì-
D) nessuna delle tre
soluzione
Il principio di Le Châtelier o di Le Châtelier-Braunè un principio di termodinamica chimica, secondo il quale ogni sistema tende a reagire ad una perturbazione impostagli dall’esterno rendendo minimi gli effetti o addirittura annullarli. La variazione della pressione o del volume influenza solo reazioni che decorrono in fase gassosa. In base al principio di Le Chatelier, per una reazione chimica in fase gassosa e all’equilibrio, un aumento della pressione (o una diminuzione del volume), determina lo spostamento dell’equilibrio verso il lato della reazione in cui si ha un minore il numero di molecole presenti. Per esempio nella reazione PCl5 <==> PCl3 + Cl2 se aumentiamo la pressione, l’equilibrio si sposta verso sinistra infatti a destra il numero di molecole è 2 cioè 1 di PCl3 ed 1 di Cl2 mentre a sinistra vi è 1 sola molecola di PCl5.
Per la reazione N2 + 3H2 <==> 2NH3 l’aumento di pressione sposta l’equilibrio verso destra perché a sinistra vi sono 3+1=4 molecole mentre a destra ve ne sono 2.
Ciò esposto poiché nella reazione CO (g)+ H2O(g) <==>CO2(g) +H2(g) non si ha variazione del numero di molecole, la pressione non ha alcuna influenza sull’equilibrio quindi la risposta corretta è D
40) Indicare il gruppo di coefficienti, riportati in ordine casuale, che bilancia la seguente reazione di ossidoriduzione:
MnO4–(aq) + H+ + S2O3-2 → Mn2+ (aq) + SO4 -2(aq)+H2O(l)
A) 5, 5, 7 ,7, 8, 10
B) 10,10,5,8,8,14
C) 10,5, 7,8.8. 14
D) 2,8. 7. 1o, 1o, 14
soluzione
8[MnO4– +8H+ 5e→ Mn+2 + 4 H2O
5[S2O3-2 +5 H2O → 2 SO4-2 +8e +10 H+
___________________________________
8 MnO4– +64H + 5 S2O3-2 + 25 H2O → 8Mn+2 +32 H2O + 10 SO4-2 + 50H+
8 MnO4– + 5 S2O3-2 + 14H+ → 8 Mn+2 + 10 SO4-2 + 7H2O
i coefficienti sono 8,5,14,8,10,7
risposta corretta C
I SUCCESSIVI QUESITI DAL 41 IN POI SONO UGUALI AI QUESITI DAL N.41 DEI GIOCHI REGIONALI DELLA CHIMICA DEL 2017 CLASSI A-B A CUI RIMANDIAMO