 ed i singoli momenti dipolari determinano un momento dipolare molecolare diverso da zero, pertanto la molecola di NH3 è polare.(come ad es H2O, CHF3,NF3,)
ed i singoli momenti dipolari determinano un momento dipolare molecolare diverso da zero, pertanto la molecola di NH3 è polare.(come ad es H2O, CHF3,NF3,)GIOCHI DELLA CHIMICA REGIONALI 2017 CLASSI A-B
Settembre 19, 2024GIOCHI DELLA CHIMICA REGIONALI 2017 CLASSI A-B
I PRIMI 40 QUESITI SONO COMUNI ALLE CLASSI A e B
1) Osservando le strutture dei seguenti composti organici, indicare quale di essi avrà lo stato di ossidazione medio più alto.

A) l
B) 2
C) 3
D) 4
soluzione
Il numero di ossidazione (n.o.) di un atomo è strettamente in relazione all’elettronegatività degli atomi cui esso è legato per formare una molecola. Il n.o. viene attribuito ad un atomo secondo le regole seguenti:
-
Se un atomo si trova allo stato elementare ad es. Zn Al C ecc.oppure se è legato ad un altro atomo uguale es come H in H2, O in O2 N in N2, gli si attribuisce n.o. zero
-
per ogni legame (2 elettroni) che lo unisce ad un altro più elettronegativo si attribuisce il valore +1
-
per ogni legame (2 elettroni) che lo unisce ad un altro meno elettronegativo si attribuisce il valore -1
L’elettronegatività è la tendenza che un atomo esercita per attrarre verso di sè la nuvola elettronica del legame. Esistono diverse scale di elettronegatività, calcolate in modo diverso, ma qui adopereremo la scala di Pauling e diamo, di seguito, il valore dell’elettronegatività del C =2,5 H = 2,1 O = 3,5.
nella molecola CH3CH2CH3
il C del CH3 ha n.o = -3 +0 =-3 il C del CH2 ha n.o. = -2+0+0 =-2
nella molecola CH3COCH3
il C del CH3 ha n.o. -3
il C del CO ha n.o. +2+0+0 =+2
l’ossigeno O ha n.o.= -2
in CH3CH2CH2OH
il C del CH3 ha n.o. -3+0=-3
il C del CH2 ha n.o. -2 +0+0=-2
il C del CH2OH ha n.o.=-2 +1 (essendo 1 solo il doppietto legato all’ossigeno) +o (è legato ad un altro C) = -1
l’ossigeno ha n.o. =-1
nella molecola CH3CH2COOH
il C del CH3 ha n.o. -3+0 =-3
il C del CH2 ha n.o. -2+0+0 =-2
il C legato a OOH ha n.o. +2 per il primo atomo di O e +1 per il secondo quindi ha n.o.=+3
Il C legato al COOH ha n.o. maggiore rispetto agli altri
NOTA:
Non esiste un n.o. medio di un composto ma solamente di un atomo in un composto, pertanto la domanda è fondamentalmente errata e fuorviante.
2) Un recipiente chiuso contiene n moli di un gas che si comporta in maniera ideale. Se la pressione viene triplicata e il volume viene ridotto a due noni di quello iniziale, la temperatura:
A) rimane costante
B) diminuisce
C) aumenta
D) non si può dare una risposta a questa domanda, in mancanza di informazioni aggiuntive
soluzione
l’equazione generale di stato dei gas ci permette di rispondere al quesito.Infatti:
PV=nRT
supponendo che i dati iniziali siano unitari cioè n=1 P= 1 e V=1 allora
T= PV/nR T= 1/R
quando P= 3 e V= 2/9 allora
T= 3 x 2/9/R= 6/9 R quindi T= 2/3 /R = 0,66/R
La temperatura del gas diminuisce
risposta corretta B
3) Per aumentare la temperatura di X moli d’acqua da 25,0°C fino a 37,0°C è necessario fornire al sistema 905,0 J sotto forma di calore. Determinare X. Si trascuri il contributo delle dispersioni e della capacità termica del contenitore. La capacità termica specifica dell’acqua è 4,1841 K-1 g-1
A) 2,0 mol
B) 3,0 mol
C) 4,0 mol
D) 1,0 mol
soluzione
Si definisce capacità termica C di un corpo il rapporto fra la quantità di calore Q scambiato tra il corpo e l’ambiente e la variazione di temperatura ΔT che ne deriva,
la capacità termica dipende dalla quantità di materia m che costituisce il corpo
- Q = m C (T2-T1) 905 = m x 4,184 x( 37 – 25) m= 905/ 4,184 x( 37 – 25)= 905/50,2
- m= 18 g di H2O che corrisponde ad 1 mole
- risposta corretta D
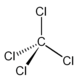
4) La molecola di fosgene (COCl2) ha geometria (posizione media relativa degli atomi):
A) trigonale piramidale e l’angolo Cl-C-CI è 104,4°
B) trigonale planare e l’angolo CI-C-CI è 111,8°
C)trigonale piramidale e l’angolo Cl-C-Cl è 114,4°
D) trigonale planare e l’angolo CI-C-CI è 121,8°
.soluzione
secondo la teoria VESPR la molecola di fosgene è del tipo AX3 che prevede una distribuzione planare trigonale
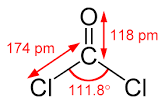
i doppietti elettronici dell’ossigeno tendono a respingere i due atomi di cloro per cui l’angolo ClCCl diviene 111,8°
risposta corretta B
5) L’unità di massa atomica, u, è equivalente a:
A) 1,66, 10-27 g
B) 1,66, 10-24 g
C) 1,66· 10-24 kg
D) 1/1836 della massa di un protone
soluzione
L’unità di massa atomica unificata (u) detta anche dalton (Da) è l’unità di misura della massa di un atomo.
Essa è definita come la dodicesima parte della massa di un atomo di 12C . 1 grammo corrisponde a 6,02 x 1023 unità atomiche
1 g = 6 , 022 × 10 23 u
pertanto se 6,02 x 1023 u corrispondono ad 1 g allora 1 unità corrisponde ad X g
6,02 x 1023 : 1 = 1 :X X= 1/ 6,02 x 1023
1 Unità corrisponde a 1,66 x 10-24 g
risposta corretta B
6) Lo ione 39K+ è costituito da:
A) 20 protoni, 20 neutroni e 19 elettroni
B) 20 protoni, 39 neutroni e 19 elettroni
C) 19 pro toni , 20 neutroni e 18 elettroni
D) 18 pro toni, 20 neutroni e 19 elettroni
soluzione
il Potassio possiede la struttura [Ar] 4S1 quindi possiede 19 elettroni e per l’elettroneutralità deve avere 19 protoni, ma avendo una massa di 39 e non di 19 è chiaro che deve avere 20Neutroni. Lo ione K+ possiede però un elettrone in meno quindi ha 18 elettroni.
In definitiva lo ione 39K+ ha 19 protoni , 20 neutroni e 18 elettroni
risposta corretta C
7) Indicare quale serie di numeri quantici è incompatibile:
A) n = 4; l = 3; m= -1; ms = +1/2
B) n = 1 ; l = 0, m = 0, m = +1/2
C) n =3 ; l=3′; m.=-2 ; ms = -1/2
D) n = 5; l = 2; m = – 2; ms= +1/2
soluzione
sappiamo che per ogni valore di n i valori di l sono quei valori compresi tra 0 ed n-1 quindi
se n=1 l=o
se n=2 si hanno 2 valori l= 0 ed l=1
se n=3 si hanno 3 valori di l l=0 l=1 l=2
da quanto abbiamo detto è chiaro che per n=3 non esiste un valore di l=3 quindi la risposta errata è C
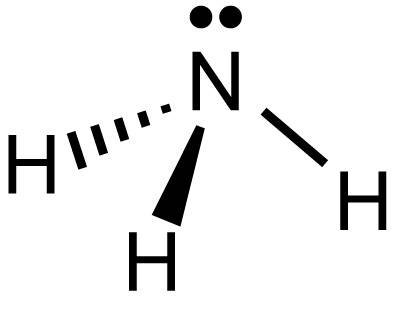
8) Quale delle seguenti molecole è polare?
A) CO2
B) BeCl2
C) NH3
D) CCl4
soluzione
la CO2 è una molecola lineare e tra C ed O vi è un momento di dipolo C→O di valore μ tuttavia essi hanno verso contrario ed il momento risultante è nullo, quindi la molecola è apolare.
BeCl2 è anch’essa una molecola lineare e pur essendo anche qui differenza di polarità tra Be e Cl il momento risultante è nullo perchè le direzioni dei due momenti Be →Cl sono di verso opposto.
Per quanto riguarda la molecola CCl4 la cui struttura è tetraedrica
 ed i singoli momenti dipolari determinano un momento dipolare molecolare diverso da zero, pertanto la molecola di NH3 è polare.(come ad es H2O, CHF3,NF3,)
ed i singoli momenti dipolari determinano un momento dipolare molecolare diverso da zero, pertanto la molecola di NH3 è polare.(come ad es H2O, CHF3,NF3,)9) Indicare qual è la formula errata:
A) Mg(HSO4)2
B) CaHPO4
C) K2H2PO4
D) NaClO
soluzione
sappiamo che lo ione fosfato è PO4-3 e che lo ione solfato è SO4-2
sappiamo inoltre che H+1 Na+1 K+1 Ca+2Mg+2
si deduce che la formula errata è C perchè 2 K hanno carica +2 e 2H hanno carica +2 ma PO4 ha solo 3 cariche negative quindi in K2H2PO4 vi sarebbe un K in più.
risposta corretta C
10) 14,0 g di azoto puro N2 sono costituiti da un numero di molecole uguale a:
A) 6,02 x 1023
B) 301 x· 1023
C) 1,20×1024
D) lo stesso numero di particelle che costituiscono 12,0 g di 12C
soluzione
sappiamo che 1 mole di una qualunque sostanza possiede un numero di atomi(molecole o ioni) pari al numero di Avogadro cioè 6,02 x 10 23 .
1 mole di azoto = 28 grammi in quanto la molecola è N2 pertanto 14 g di azoto contengono 6,02 x 10 23 ./2 = 3,01 x 10 23 molecole.
risposta corretta B
11) Quanti grammi di K2Cr2O7 è necessario decomporre per ottenere 2,56 . 1025 atomi di potassio?
A) 6,25· 103 g
B) 13,18 kg
C) 39,5· 103 g
D) 26,4 kg
soluzione
se 1 mole di potassio (6,02 x 1023 atomi ) pesa 39,0 g allora 2,56 x 1025 pesano Xg
Xg= 2,56 x 1025 x 39 /6,02 x 1023 = 99,84 x 1025 /6,02 x 1023 = 16,58 x 102
quindi se da K2Cr2O7 si ottengono 2K = da X si otterranno 16,58 x 10² g
294,1 : 2 x 39 = X :16,58 x 10²
X= 6251,5 g = 6,25 x 10³ g = 6,25 Kg
12) Calcolare la massa di Ca3(PO”)2 che si ottiene quando si. consumano 0,150 mol di Ca(OH)2 nel corso della reazione (da bilanciare):
Ca(OH)2+ H3PO4(aq) → Ca3(PO4)2 + H2O
A) 6,75 g
B) 46,5 g
C) 139,5 g
D) 15,5 g
soluzione
la reazione bilanciata è
3Ca(OH)2+2 H3PO4(aq) → Ca3(PO4)2 + 6 H2O
da 3 moli di Ca(OH)2 si ottiene 1 mole di Ca3(PO4)2 da 0,15 moli se ne ottengono X
moli ottenute= 0,15 x 1/3 =0,05 moli di Ca3(PO4)2
0,05 moli corrispondono a 0,05 x PM=g g= 0,05 x 310,2 = 15,51 g
risposta corretta D
13) Determinare la formula minima di una sostanza che all’analisi elementare ha dato i seguenti valori di composizione percentuale:
sodio: 18,85%; cloro: 28,69%; ossigeno: 52,46%.
A) NaClO
B) NaCIO2
C) NaClO3
D) NaCIO4
soluzione
dividiamo le percentuali per il peso atomico
Na 18,85 /23 = 0,819 28,69 /35,5 =0,81 52,46 /16 =3,28
dividiamo ciascun rapporto per il numero più piccolo che è 0,81 ed otteniamo i singoli rapporti atomici:
Na= 0,819/0,81 = 1 Cl =0,81/0,81 = 1 O = 3,28/0,81 =4
Na =1 Cl=1 O = 4
La formula minima è NaClO4
risposta corretta D
14) L’antimonio ha massa atomica 121,760 u ed esiste in natura come miscela dei due isotopi 121Sb e lnsb. L’isotopo 121Sb ha massa 120,904 u e abbondanza naturale del 57 ,21 %. Determinare la massa e l’abbondanza naturale delI’isotopo 122Sb:
A) 119,103 u, 42,79%
B) 123,401 u,42,79%
C) 122,904 u, 53,24%
D) 122,904 u, 42,79%
soluzione
gli elementi chimici in natura si presentano sotto forma di miscele di due o più isotopi e la percentuale in massa con cui ognuno di essi è presente è chiamata abbondanza isotopica relativa. Il peso atomico di un elemento non è altro che la somma dei prodotti
PESO ATOMICO = (abbondanza isotopo 1 x massa isotopo 1) + (abbondanza isotopo 2 x massa isotopo2) + ….+ (abbondanza isotopo N x massa isotopo N) /100
Nel caso del quesito sappiamo che:
peso atomico=121,76 u
%abbondanza % 121Sb = 57,21%
massa isotopo 121Sb= 120,904
da questi dati si calcola l’abbondanza % dell’isotopo 122Sb =100- 57,21 = 42,79 %
la massa di 122Sb viene calcolata da :
PESO ATOMICO = (abbondanza isotopo 1 x massa isotopo 1) + (abbondanza isotopo 2 x massa isotopo2) /100 pertanto:
121,76 = ( 57,21 x 120,904 ) + ( 42,79 x massa ) /100
12176 – 6916,91 /42,79 = massa
massa = 5259,09/42,79
massa = 122,904 u
risposta corretta D
15) L’ozono è una forma allotropica dell’ossigeno ed ha formula O3. Calcolare quanti atomi di ossigeno costituiscono una mole di ozono.
A ) 18,066 x 1024 atomi
B) 6,022· 1023 atomi
C) 8,414· 1023 atomi
D) 18,066· 1023 atomi
soluzione
occorre ricordare che nell’ozono vi sono 3 grammo-atomi di ossigeno e dal momento che in ogni grammo-atomo di un qualunque elemento vi sono 6,02 x 1023 atomi, nella molecola di Ozono vi sono 3 x 6,02 x 1023 atomi.
Pertanto il numero di atomi nella molecola di Ozono = 3 x 6,02 x 1023 = 18,06 x 1023 atomi
16) Indicare la risposta che riporta tutti i valori di m compatibili con l= 3
A) + ½ ; – ½
B) -2;-1;0;+1;+2
C) -3;-2;-1;0;+1;+2;+3.
D) -3; +3.
soluzione
ricordiamo che affinchè i numeri quantici n,l,m che compaiono nella funzione d’onda ψ,siano soluzione dell’equazione di Eisenberg (equazione che fornisce l’energia dei livelli elettronici dell’atomo ) e forniscano valori diversi da zero, devono assumere valori ben precisi ed in relazione tra loro. Infatti:
n può assumere valori compresi tra 1 e infinito n=1,2,..,∝
l può assumere tanti valori quanti sono i valori interi che vanno da 0 ad n-1 cioè l= 0,1,….n-1
m può assumere valori compresi tra + l e – l compreso lo 0 m = +l,0,-l
S può assumere 2 soli valori : +½ e -½
Si deduce che quando n= 4 si possono avere i valori di l cioè l=0 ; l=1; l=2; l=3
per ogni valoe di l si hanno i seguenti valori di m
m=0 se l=0 ( si ha uno stato S cioè un orbitale S)
m= +1,0,-1 se l=1 (si hanno i 3 stati P cioè i 3 orbitali PxPyPz) se l= 1
m=+2,+1,0,-1,-2 se l= 2 (si hanno 5 stati d) se l=2
m= +3,+2,+1,0,-1,-2,-3 se l=3 (si hanno 7 stati f ) se l=3
è chiaro quindi che la risposta corretta è C
17) Indicare la configurazione elettronica della specie Cl–
A) [Ne] 3s23p5
B) [Ne] 3s23p6
C) [Ne] 3s23p4
D) [Ne] 3s23p8
soluzione
il cloro ha n.atomico 17 e pertanto possiede 17 elettroni.
lo ione Cl- ha pertanto un elettrone in più e quind possiede 18 elettroni la cui distribuzione è:
1S² 2S² 2P6 3S2 3Px23Py23Pz2
essendo 1S² 2S² 2P6 = [Ne]
configurazione elettronica di Cl- = [Ne]3S2 3Px23Py23Pz2
risposta corretta B
18) 3,00 g di palladio metallico reagiscono esattamente con 2,00 g di cloro molecolare secondo la seguente reazione:
Pd(s) + x/2Cl2(g) →PdClx(s)
Determinare la formula del cloruro PdClx:
A) PdCl5
B) PdCl4
C) PdCI3
D) PdCl2
soluzione
le quantità in moli che reagiscono sono
moli di Pd= 3/ 106,5= 0,0282 moli
moli di Cl2 = 2/71=0,282 moli
è chiaro che il rapporto Pd/Cl2 è 1/1 quindi la formula della molecola è PdCl2
risposta corretta D
19) 1,51 g di un idrossido di formula M(OH)3 subiscono una decomposizione termica secondo la reazione:
M(OH)3(s) →½ M2O3 (s) + 3/2 H2O(g)
Se la perdita in peso della fase solida è 0,400 g, di quale idrossido si tratta?
A) Al(OH)3
B) B(OH)3
C) V(OH)3
D) Fe(OH)3
soluzione
la perdita in peso è relativa all’acqua che evapora è 0,4 g per cui
0,4/18= moli H2O = moli M(OH)3= 0,02moli
dalla reazione
2 M(OH)3(s) → M2O3 (s) + 3 H2O(g)
si evince che 2 moli di M(OH)3 producono 0,4/18 = 0,02 moli di H2O
2 x 1,51/(x + 3x 17) =2 x 1,51/2 (x+51)= 0,02
(X+51) x 0,02=3,02
0,02X + 1,02= 3,02
X= 3,02-1,02/0,02 = 100
ma dalla reazione sopra scritta sappiamo che 2 M = X
pertanto il p.a. di M è 100/2=50
non può essere l’idrossido di Al perchè Al ha p-a-=26,98
non può essere l’idrossido di B perchè ha p-a-= 10,81
non può essere l’idrossido di Fe perchè Fe ha p-a-=55,8
l’elemento X è il Vanadio il cui p.a.= 50 formula è V(OH)3
20) Facendo reagire quantità equimoJari di NH3 e HBr il prodotto della reazione sarà:
A) un sale
B) un’anidride
C) un ossido
D) nessuno dei precedenti
soluzione
la reazione è la seguente
NH3 + H+ + Br- → NH4+ + Br- → NH4Br
NH4Br è un sale
risposta corretta A
21) Indicare le formule corrette dei sali che si formano quando l’anione HPO3– 2 si lega con i cationi NH4+, Ba2+ e Co+3
A) NH4HPO3, BaHPO3, Co2(HPO4)3
B) (NH4)2HPO3; Ba(HPO3)3′ Co(HPO3)3
C) (NH4)2HPO3, BaHPO3, Co2(HPO3)3
D) NH4HPO3 , BaHPO3, C03(HPO3)3
soluzione
ricordando che in una reazione A+x + B-y gli esponenti di un elemento o gruppo divengono i pedici dall’elemento o gruppo opposto si ha A+x + B-y → Ay Bx
le reazioni pertanto sono le seguenti:
NH4+ + HPO3-2 → (NH4)2HPO3
1 2 2 1
Ba+2 + HPO3-2 → BaHPO3
2 2 (si semplifica) 1 1
Co+3 + HPO4-2 → Co2 (HPO4)3
3 2 2 3
risposta corretta C
22) Quale dei seguenti composti ha maggiore carattere ionico?
A) Fe2S3
B) PF5
C) KBr
D) TiC14
soluzione
Sappiamo che il carattere ionico è maggiore in una molecola il cui legame si stabilisce tra elementi che nella tavola periodica si trovano tra loro più distanti. Tra i composti del quesito, gli elementi più distanti nella tavola periodica sono K e Br per cui è questa la molecola con più carattere ionico.
risposta correttav C
soluzione23) Indicare la sequenza che riporta, nell’ ordine corretto, i coefficienti che permettono di bilanciare la reazione:
AgH(s) + HClO4(aq)→ Cl2 (g) + H2O (I) + AgClO 4(aq)
A) 6; 9; 3; 7; 6
B) 7; 9; 1; 8; 7
C) 9; 7;2;8j9
D) 8-4, 2,7-8
soluzione
la reazione è una ossidoriduzione in cui l’idrogeno dell’idruro (AgH) cioè H- si ossida ad H+ mentre il cloro del ClO4- si riduce a Cl2°
7 [2H- → 2H+ +2e
1 [2ClO4- +16H+ + 14e → Cl2 + 8H2O
_________________________________
14H- + 2ClO4- + 16H+ → 14 H+ + Cl2 + 8H2O
7 H- +ClO4- +8H+ → 7H+ + Cl2 +4H2O
la reazione opportunamente bilanciata è :
7 AgH(s) + 9 HClO4(aq)→ Cl2 (g) + 8 H2O (I) + 7AgClO 4(aq)
risposta corretta B
24) Mettendo a reagire 5,66 g di SiO2(aq) con un eccesso di Na2CO3(aq) la reazione che segue (da bilanciare) procede con una resa del 70,0%.
Na2CO3(aq) + SiO2(aq) → Na2SiO3(aq) + CO2(g)
Calcolare la quantità di CO2(g) che si può ottenere.
A) 1,63 g
B) 2,90 g
C) 5,80 g
D) 1,45 g
soluzione
la reazione bilanciata è :
Na2CO3(aq) + SiO2(aq) → Na2SiO3(aq) + CO2(g)
per calcolare quanta CO2 si ottiene da 5,66 g di SiO2 occorre fare la proporzione
se da una molecola di SiO2 si ottiene una molecola di CO2 da 5,66 g se ne ottengono X
SiO2:CO2 = 5,66 : X 60: 44 = 5,66 :X X= 5,66 x 44/ 60 = 4,15 g
Dal momento che la resa è del 70% allora la quantità che si ottiene è:
se da 100 se ne ottengono 70 , da 4,15 se ne ottengono X
X= 70 x 4,15 / 100 = 2,9 g
risposta corretta B
25) Calcolare la densità di SO2(g) a 273 K e 1,01 -105 Pa.
A) 1,88 g/L
B) 1,35 g/L
C) 1,21 g/L
D) 2,86 g/L
soluzione
risposta corretta D
26) Per determinare la concentrazione di una soluzione acquosa di HCI il cui titolo esatto è 0,1005 ± 0,0003 M, uno studente esegue quattro titolazioni. Dalle misure effettuate ottiene i valori che seguono:
0,1151 M; 0,1149 M; 0,1152 M; 0,1150 M.
Le misure eseguite sono:
A) accurate ma non precise;
B) precise ma non accurate;
C) precise e accurate;
D) né precise né-accurate
soluzione
Una misura è tanto più precisa quanto più i singoli valori ottenuti si concentrano intorno alla media delle misure effettuate.
Una misura è tanto più accurata quanto più la media delle misure si approssima al valore vero della grandezza misurata.
Dai dati ottenuti dallo studente si osserva che essi sono precisi, in quanto i valori ottenuti sono molto vicini alla media dei valori:
infatti la media è (0,1151 + 0,1149 +; 0,1152 + 0,1150 )/4= 0,4602/4 = 0,11505 M
ed ogni valore ottenuto è molto vicino alla media.
Le misure tuttavia, non sono accurate in quanto il valore vero è 0,1,005 ± 0,0003 dove 0,0003 rappresenta il doppio della deviazione standard. I valori accettabili avrebbero dovuto essere compresi tra 0,1005 – 0,003 e 0,1005 + 0,003 , ma tutti i valori ottenuti dallo studente sono fuori da questo intervallo per cui nessuno dei valori è accettabile.
Le misure pertanto, sono precise ma non accurate.
risposta corretta B
27) Un brandy ha una concentrazioae di alcol etilico del 43,0% (vol/vol). Calcolare la corrispondente concentrazione in % (peso / peso), sapendo che la densità dell’alcol etilico è 0,789 g/ml e la densità del brandy è 0,977 g/ ml
A) 21,5%
B) 34,7%
C) 45,7%
D) 17,9%
soluzione
i grammi corrispondenti al 43% in volume sono g= V x densità perciò:
0,789 x 0,43 = 33,92g di alcool
0,977 x 100 = 97,7 g di brandy
ottenuti i grammi possiamo calcolare la % in peso %p/p
97,7:33,92 =100 :X X= 3392/97,7 =34,7 % p/p
risposta corretta B
28) Il fosforo si può preparare a 1500°C utilizzando la reazione (da bilanciare):
Ca3(PO4)2(s) + SiO2(s) + C(s) → CaSiO3(s) + P4(s) + CO(g)
Quante moli di C occorrono per produrre 3,0 moli di P 4 ?
A) 62 mol
B) 30 mol
C) 48 mol
D) 21 mol
soluzione
la reazione bilanciata è:
2Ca3(PO4)2(s) + 6SiO2(s) +10 C(s) → 6CaSiO3(s) + P4(s) + 10CO(g)
da cui si evince che da 10 moli di C si ottiene 1 mole di P4, pertanto 3 moli si ottengono da 30 moli di C
risposta correta B
29) Quale composto contiene la più alta percentuale in peso di carbonio?
A) BaC2O4.,2H2O
B) CdCO3
C) Ni(CN)2
D) MnCO3
soluzione
se in BaC2O4.,2H2O vi sono 2 atomi di C in 100 :X X= 2×12 x100/225,3 X=10,65%
se in CdCO3 vi è 1 atomo di C in 100 ve ne sono X X= 12 x100/172, X=6,96 %
se in Ni(CN)2 vi sono 2 atomi di C in 100 ve ne sono X X = 12×2 x100/ 110,7 = X= 21,7 %
se in MnCO3 vi è 1 atomo di C in 100 ve ne sono X X=12 x 100/114,9 X= 10,44%
la maggior % di C è contenuta in Ni(CN)2
risposta corretta C
30) Calcolare quanti L di una soluzione 0,058 M di glucosio contengono la stessa quantità di soluto presente in 0,25 L di una soluzione 0,080 M di glucosio.
A) 0,18 L
B) 0,24 L
C) 0,57 L
D) 0,34 L
soluzione
sappiamo che
volume x Molarità = volume x Molarità quindi
0,25 x 0,08 = X x 0,058
X= 0,25 x 0,08 /0,058 = 0,344 litri
risposta corretta D
31) La concentrazione di caffeina C8H10N4O2 in una bevanda energetica è 1,38 . 10-3 M. Qual è la concentrazione di C8H10N4O2 in % (peso/volume) nella bevanda?
A) 0,027%
B) 0,053%
C) 0,015%
D) 0,087%
soluzione
1,38 . 10-3 M significa che in 1 litro vi sono 1,38 . 10-3 Moli di caffeina che corrispondono a
grammi di caffeina= 1,38 . 10-3 x PM caffeina = 1,38 . 10-3 x 194 = 1,38 . 10-3 x 194= 0,267 g in 1000 ml
se in 1000 ml vi sono 0,267 g in 100 ve ne sono X
X= 0,267 x 100/1000 = 0,0267 % =0,027 %
32) Quanta acqua occorre aggiungere a 60 g di una soluzione di NaNO 3al 45% in peso per ottenere una soluzione al 18% di NaNO3?
A) 10 g
B) 20g
C) 90g
D) 40g
soluzione
utilizzando il sistema a croce
45 18 parti di NaNO3 al 4%%
\18/
0 27 parti H2O
si vede che per 18 g di NaNO3 al 45% occorrono 27 g l di H2O quindi per 60 g ne occorrono X
18:27=60:X X= 60 x 27/18 = 90 g
risposta corretta C
33) Calcolare il pH di una soluzione ottenuta mescolando 50,0 mL di una soluzione acquosa di HCI 0,020 M con 10,0 mL di una soluzione acquosa di NaOH 0,060 M.
A) 3,55
B) 4,70
C) 6,20
D) 2,17
soluzione
abbiamo inizialmente una quantità di HCl pari a
50,0 ml x 0,02 = 1,0 mequivalente di acido
aggiungiamo una quantità di base NaOH pari a
10 x 0,06 =0,6 milliequivalent di base
quindi si formano 0,6 mequivalenti di sale e rimangono 1,0- 0,6 = 0,4 mequivalenti di acido che però adesso si trovano in un volume di 50+ 10=60 ml
la nuova concentrazione di acido è quindi 0,4/60 = 6 x 10-3
pertanto [H+]= 6 x 10-3 PH = 3-log 6 =03-0,7 = 2,2
risposta corretta D
34) Indicare quale composto possiede la più alta percentuale di Si:
A) SiO2
B) SiC
C) SiF4
D) Si3N4
soluzione
SiO2: Si = 100 :X 60:28 = 100:X X= 46,6 %
SiC:Si = 100:X 40:28 =100:X X= 70 %
SiF4:Si = 100:X 104:28= 100 :X X=26,9 %
Si3N4 :3Si =100 :X 140,2: 3 x 28 =100 :X X= 59,9 %
la maggior quantità in % di Si si trova nel composto SiC
risposta corretta B
35) Calcolare le concentrazioni molari di Ca2+ e di Mg2+ in un’ aqua minerale che contiene 120 mg/l di Ca2+(aq) e 25,0 mg/l di Mg2+(aq).
A) 9,71 ·10-3 M; 4,22 .10-3 M
B) 7,55 .10-3 M; 3,68 . 10,.3 M
C) 2,99 .10–3 M; 1,03 .10-3 M
D) 5,74 .10-3 M; 3,35 .10-3 M
soluzione
[Ca+2]=0,120 g/40 = 2,99 x 10-3 M
[Mg+2]=0,025 g /24,3 = 1,03 x 10-3 M
risposta corretta C
36) Quante moli di H+ (aq] si consumano per “disciogliere” 2,0 moli di Mn(s), secondo la reazione (da bilanciare):
Mn(s) + MnO2(s)+ H+(aq) → Mn2+(aq)+H2O(aq)
A) 6,5 mol
B) 3,7 mol
C) 2,5 mol
D) 8,0 mol
soluzione
si tratta di una reazione di ossidazione ed una di riduzione in cui Mn si ossida ad Mn+2 ed Mn+4 si riduca da Mn+2
Mn → Mn+2 +2e
MnO2 +2e + 4H+ → Mn+2 + 2 H2O
________________________
Mn + MnO2 +4H+ → 2 Mn+2 + 2H2O
pertanto si evince che per 1 mole di Mn(s) occorre usare 4 moli di H+ pertanto per 2 moli di Mn(s) occorre usarne 4 x 2 = 8 moli
risposta corretta D
37) Calcolare la molarità dell’ammoniaca in una soluzione ottenuta disciogliendo 653 mL di NH3(g) misurati a 293 K e 9,56 . 104 Pa in 1,00 mL di soluzione .
A) 11,9 M
B) 32,7 M
C) 12,7 M
D) 25,5 M
soluzione
sappiamo che la molarità= moli /Peso molecolare e quindi occorre calcolare la moli di NH3.
Essendo NH3 un gas a 293K e 9,56 x 104 Pa le moli si calcolano da PV(in litri)=nRT
n=PV/RT n= 9,56 x 104 x 0,653 / 293 x 8314 = 6,24 x 104 /2436= 2,56 x101
pertanto la Molarità dell’NH3 è M= 2,56 moli/l
risposta corretta D
38) Calcolare quante moli di metano si consumano per produrre 8,0 mol di H2S(g) secondo la reazione (da bilanciare):
CH4(g) + S2(s) →CS2(l) + H2S(g)
A) 2,7 mol
B) 4,0 mol
C) 8,3 mol
D) 7,4 mol
soluzione
la reazione bilanciata è:
CH4(g) + 2S2(s) →CS2(l) + 2H2S(g)
per cui 1 mole di metano produce 2 moli di H2S per cui X moli di metano ne producono 8
1:2 = X: 8 X= 8/2 = 4 moli di metano
risposta corretta B
39) Il pH di una soluzione contenente 0,74 g/L di un acido organico debole HY, con costante acida Ka = 1 x 10-6 è PH= 4,0. Calcolare la massa molare dell’acido.
A) 74,0 g /mol
B) 63,8 g/ mol
C) 95,4 g /mol
D) 55,3 g/ mol
soluzione
Ricordiamo che la massa molare dell’acido corrisponde al suo peso molecolare PM
Se il PH= 4 allora [ H+] =10-4
la [HY] = 0,74/PM
sapendo che per un acido debole HY che si dissocia HY<==> H+ +Y-
Ka= [H+]² /[HY] avremo Ka= [H+]² / 0,74/PM quindi
Ka x 0,74/PM = [H+]² PM = Ka x 0,74 / [H+]²
PM= 0,74 x 1 x 10-6 / 10-8 = 0,74 x 102 = 74 g /mol
risposta corretta A
40) Bombardando atomi di litio con neutroni(10n ), si ottengono idrogeno ed elio, secondo la reazione:
6 3 Li +10n →xy H + 42He
Determinare i valori. di x e y.
A) x = 3; y = l
B) x = 2; y = 3
C) x = l; y = 1
D) x = 1; y = 2
soluzione
poichè la massa deve essere conservata, la somma tra protoni e neutroni prima della reazione è 6+ 1 =7 in totale, e siccome l’elio He ha 2 protoni e 2 neutroni (cioè massa 4) e 2 elettroni, necessariamente sull’idrogeno devono esservi 7 -4 = 3 tra protoni e neutroni (cioè un protone e due neutroni) ed 1 solo elettrone .
La risposta corretta è A
QUI’ CONTINUANO I QUESITI DELLA CLASSE A
41) Un recipiente del volume di 1,00 m3 contiene 10,0 kg di ossigeno alla pressione di 1x 106 Pa. Qual è la temperatura nel recipiente?
A) 385 K
B) 345 K
C) 305 K
D) 265 K
soluzione
Possiamo calcolare la temperatura T dell’ossigeno ricordando che PV=nRT da cui T= PV/nR
pertanto 1 x 106 x 1000 / (10000/32) x 8,314 = T
T= 1000 x 106/312,5 x 8314= 1x 109/2598125= 384,9×109 / 109
T= 384,9 K
risposta corretta A
42) Due sistemi sono in contatto attraverso una parete conduttrice di calore. Quando viene raggiunto uno stato di equilibrio essi hanno:
A) uguale energia
B) uguale temperatura
C) uguale energia e uguale temperatura
D) uguale capacità termica
soluzione
43) Se 13,5 g di un gas X occupano 6,87 L misurati a 273 Ke a 1,01 . 105 Pa, qual è la sua massa molare?
A) 65,9 g/ mol
B) 44,0 g/ mol
C) 56,2 g /mol
D) 33,4 g/ mol
soluzione
la massa molare non è altro che il Peso Molecolare del gas X e poichè per un gas ideale PV=n RT
dove n=moli= g/PM si ha
n= PV/RT n= 1,01 x 105 x 6,87 /8,314 x 273= 6,939 x 105/ 2,269 x106 =0,306 moli
quindi moli= g/PM cioè PM= 13,5/ 0,306 PM=44 g/mol
risposta corretta B
44) Calcolare il pH di una soluzione ottenuta diluendo 2,0 mL di una soluzione acquosa di HCI 12,0 M con 0,65 L di acqua (assumere i volumi additivi):
A) 1,44
B) 2,55
C) 3,21
D) 4,05
soluzione
il PH = -log[H+] pertanto occorre conoscere la [H+] dopo la diluizione con 0,65 l di H2O-
gli equivalenti di acido iniziali sono : 0,002 litri x 12 M= 0,024 equivalenti
questi vengono diluiti con 0,650 l di H2O e dopo aggiunta il volume finale è 0,650 + 0,002 = 0,652 litri.
La nuova concentrazione dell’acido è quindi [H+] = 0,024/0,652 = 0,0368 M
il PH = -log [H+]= -log 3,68 x 10-2 = 2-log 3,68 = 2-0,566= 1,,44
risposta corretta A
45) La concentrazione di pentano nell’aria di ambienti industriali non può superare il valore di 810 ppm. Indicare qual è il valore limite di pentano in %(voI/vol):
A) 0,027%
B) 0,12%
C) 0,081%
D) 0,22%
soluzione
ppm significa parti per milione quindi se 810 ml sono contenuti in 106 ml di aria allora X saranno contenuti in 100( otteniamo così la %).
810 :106 = X : 102 da cui si ha X = 81000 x 10 -6
X= %(v/v) = 0,081 %
risposta corretta C
46) Per preparare una soluzione acquosa l M di NaCI si è utilizzato un matraecio da l L. Nell’ aggiungere acqua al sale, il menisco della soluzione ba superato il livello indicato dalla tacca. Si è deciso di eliminare parte della soluzione ottenuta in modo da riportare il livello a 1000 mL. La soluzione contenuta nel matraccio avrà una concentrazione:
A) < l M
B) > 1 M
C) = l M
D) non si può dire nulla sulla concentrazione
soluzione
se il volume ha superato il limite del matraccio, significa che è stato aggiunto un pò di solvente in più , quindi NaCl è leggermente più diluito rispetto ad 1 M ed evidentemente la concentrazione sarà leggermente inferiore ad 1.
risposta corretta A
47) La solubilità di una sostanza in acqua indica:
A) la quantità di sostanza che si discioglie nell’acqua
B) la tendenza della sostanza a disciogliersi in acqua
C) la quantità massima di sostanza che si discioglie in una determinata quantità di acqua
D) la velocità con cui la sostanza si discioglie nell’acqua
soluzione
Si definisce solubilità di una sostanza in un solvente, a determinate condizioni di pressione e temperatura, la massima quantità di sostanza che si scioglie senza creare un corpo di fondo. In questo caso la soluzione si dice “satura” perchè ha raggiunto la massima concentrazione di soluto in soluzione . Tuttavia se durante lo scioglimento della sostanza utilizziamo il calore, essa può sciogliersi oltre questo limite e non forma ancora il corpo di fondo : la soluzione si dice soprassatura. Tuttavia,questa situazione è molto instabile, e per raffreddamento o per agitazine, la soluzione tenderà a riportare il soluto al massimo della sua solubilità eliminando l’eccesso sotto forma di corpo di fondo(Precipitato).
da quanto sopra, la risposta corretta è C
48) Indicare la formula bruta del composto idrogenocarbonato di calcio.
A) CaC03
B) Ca (HCO3)2
C) CaCO2
D) CaH2CO3
soluzione
il termine idrogenocarbonato indica un composto contenente lo ione carbonato CO3-2 e l’idrogeno H+. Lo ione idrogenocarbonato è quindi HCO3- .Pertanto, il composto non può essere nè A nè C. Il composto D pur avendo sia il carbonato che l’idrogeno, tuttavia possiede 2 atomi di H e 1 atomo di Ca per cui si ha una molecola che non è elettricamente neutra . Si deduce che la molecola indicata è Ca(HCO3)2.
risposta corretta B
49) Indicare in quale delle seguenti specie l’azoto ha numero di ossidazione +5.
A) N2
B) HNO3
C) NO2
D) NO2-
soluzione
ricordiamo che il n.o. di un atomo è in relazione all’ elettronegatività degli atomi cui è legato quindi nel composto HNO3 l’azoto è legato con 3 doppi legami all’ossigeno che è più elettronegativo per cui all’azoto si attribuisce il numero 3 x 2 =+6 ma poiché è legato anche ad un atomo di H che è meno elettronegativo gli si ha attribuisce anche -1. In definitiva il n.o. dell’N in HNO3 è +6-1=+5. Seguendo lo stesso metodo vediamo che in N2 l’azoto ha n.o.zero mentre in NO2 il n.o.= 2x+2=+4 e per NO2- si ha n.o. = 2 x +2-1= +3
La risposta corretta è quindi B
50) Completa in modo corretto la frase: gli isotopì 12C e 14C differiscono per
A) due protoni
B) due neutroni
C) un protone e un neutrone
D) due elettroni
soluzione
51) Indicare quale delle seguenti quantità di sostanze elementari è costituita dal maggior numero di atomi:
A) 56,0 g di ferro
B) 46,0 g di sodio
C) 100 g dì platino
D) 180 g di piombo
soluzione
I pesi atomici sono:
Fe= 55,85 g Na =22,98 g Pt = 195 g Pb= 207 g
Sappiamo che in una quantità pari al peso atomico vi sono 6,02 x 1023 atomi quindi:
se in 55,85 g di Fe vi sono 6,02 x 1023 atomi, in 56 : X X= 6,02 x 1023 atomi
22,98 : 6,02 x 1023 = 46 :X X= 12 x 1023 atomi
195: 6,02 x 1023 =100 :X X= 3,08 x 1023 atomi
207 : 6,02 x 1023 = 180: X X= 5,23 x 1023 atomi
dai dati si evince che il sodio contiene il maggior numero di atomi
risposta corretta B
52) Indicare quale delle seguenti coppie di specie chimiche ha la stessa configurazione elettronica.
A) He,I-
B) H-, Al+3+
C) Na, Mg2+
D) O2-, F-
soluzione
la struttura elettronica è :
He 1S2
I- [ Kr]4d10 5s2 5p4
H- 1S2
Al+3 [Ne] 3s23p1 meno 3 elettroni [Ne]
Na [Ne] 3s1
Mg+2 [Ne]
O-2 1s2 2s2 2p6 perchè O-2 ha 6 elettroni P
F- 1s2 2s22p6
gli ioni isoelettronici (che hanno la stessa configurazione elettronica) sono O-2 ed F-
risposta corretta D
53) Completare in modo corretto la frase:L’energia di prima ionizzazione è:
A) l’energia che si libera quando un atomo cede un elettrone di valenza
B) maggiore se l’elettronegatività dell’elemento è maggiore
C) maggiore quella dei metalli alcalini di quella degli alogeni
D) zero quella dei gas nobili
soluzione
L’energia di ionizzazione di un atomo è l’energia minima richiesta per allontanare un suo elettrone a distanza infinita, a 0 K e in condizioni di energia cinetica nulla cioè ad elettrone fermo.
-
- X(g) → X+(g) + e− I1
la ionizzazione è un processo endotermico e quindi il valore di I1 è positivo. E’ anche possibile allontanare un altro elettrone dal catione che si è formato e l’energia necessaria è chiamata energia di seconda ionizzazione e si indica con I2.
X+(g) → X2+(g) + e− I2
L’energia di Ionizzazione dipende dalla distanza degli elettroni esterni dal nucleo; infatti man mano che questa distanza aumenta, diminuisce l’attrazione del nucleo sugli elettroni e quindi occorre minore energia per strapparli dall’atomo. Accanto a questo effetto attrattivo vi è anche l’effetto schermante degli elettroni interni : infatti, se gli elettroni esterni sono attratti dal nucleo, essi sono anche respinti dagli strati più interni di elettroni. L’E.I. dipende pertanto dalla forza di attrazione esercitata da un nucleo verso i propri elettroni, ma dipende anche dall’ affinità elettronica che indica con quanta forza elettroni non appartenenti all’atomo possano da questi essere attirati.Un’altra caratteristica di un atomo è l’elettronegatività che è la tendenza ad attrarre gli elettroni di legame ed è intuitivo che maggiore è l’elettronegatività maggiore sarà l’energia di ionizzazione proprio perché aumenta la forza di attrazione esercitata dal nucleo verso gli elettroni.
La risposta corretta del quesito è pertanto B
54) Indicare l’affermazione errata tra le seguenti:
A) il volume dell’atomo di Mg è uguale a quello dello ione Mg2+ – .
B) l’atomo di fluoro è più piccolo dell’atomo di ossigeno e dell’atomo di cloro
C) l’atomo di elio è il più piccolo della tavola periodica .
D) all’interno di ogni periodo, gli elementi del primo gruppo hanno il raggio atomico maggiore
soluzione
Il volume di un atomo è strettamente collegato al raggio atomico.Il raggio atomico è definito per convenzione la metà della distanza tra i nuclei di due atomi dello stesso elemento legati tra loro con legame covalente. Ad esempio il raggio atomico dell’ossigeno è rappresentato dalla metà del segmento immaginario che collega i due nuclei dei due atomi di ossigeno .I raggio atomico si misura raggio in picometri (pm) oppure in Angstrom(Å).
In ogni gruppo della tavola periodica, il raggio atomico aumenta ; infatti,man mano che aumenta il numero di elettroni vengono occupati gli orbitali più esterni che sono più lontani dal nucleo e nel contempo la carica elettrica dell’elettrone esterno viene schermata dagli elettroni più interni ed il nucleo con la sua carica positiva agisce di meno su questi elettroni.
In ogni periodo della tavola periodica, invece, il raggio atomico diminuisce; infatti, pur aumentando il numero di elettroni essi occupano lo stesso orbitale o livello di energia e quindi si trovano alla stessa distanza dal nucleo .Ne consegue che i protoni (che aumentano come gli elettroni) non sono schermati in modo efficace dagli elettroni presenti e che sono equidistanti dal nucleo.
Nella tavola periodica in basso a sinistra troviamo gli elementi con raggio atomico maggiore ed in alto a destra troviamo gli elementi con raggio atomico minore.
I cationi sono sempre più piccoli degli atomi da cui derivano perché, come abbiamo già visto, quando un atomo perde un elettrone, pur diminuendo la carica negativa complessiva, tuttavia la carica positiva (quella dei protoni nel nucleo) resta invariata ed in conseguenza le forze repulsive tra le cariche negative degli elettroni diminuiscono, mentre aumentano le forze attrattive verso il nucleo e di conseguenza, le dimensioni del catione sono inferiori rispetto all’atomo neutro.
Il volume di un atomo, che supponiamo sferico , è : V= 4/3π r³ quindi se r ,che è il raggio, diminuisce ovviamente diminuisce anche il volume e viceversa.
Questa discussione ci permette di rispondere al quesito, in quanto è evidente che Mg ed Mg+2 non possono avere uguale volume atomico in quanto in Mg+2 il nucleo esercita sugli elettroni un’attrazione più efficace che non in Mg ed il raggio atomico diminuisce rispetto al raggio di Mg quindi il volume diminuisce.
55) Indicare l’affermazione corretta, tra le seguenti, che riguarda l’elemento con configurazione elettronica [Ne] 3s2 2d5:
A) è un metallo di transizione
B) è un alogeno
C) è un elemento del terzo periodo
D) non esiste
soluzione
secondo il principio aufbau, gli orbitali vengono riempiti partendo dall’orbitale ad energia più bassa e gli orbitali sono:
1S 2S 2Px 2Py 2Pz 3S 3Px3Py 3Pz 4S 3d 4Px4Py 4Pz 4(d1 d2 d3 d4 d5) 4(f1 f2 f3 f4 f5 f6 f7)
come si può notare non esiste alcun orbitale 2d e di conseguenza non può esistere un atomo che abbia la configurazione data nel quesito.
la risposta corretta è D
56) Gli atomi di Al, O, e S (in ordine alfabetico) hanno affinità elettronica AE diversa. Indicare la sequenza che riporta la corretta relazione tra i diversi valori:
A) AEAl >AEo > AEs
B) AEo=AEs>AEAl
C) AEo > AEs > AE Al
D) AE s > AE o > AE Al
soluzione
l’affinità elettronica è la quantità di energia rilasciata o assorbita, quando ad un atomo neutro isolato in condizioni di gas monoatomico si aggiunge un elettrone per formare uno ione gassoso con carica −1 .La maggior parte degli elementi hanno affinità elettronica negativa in quanto durante il processo rilasciano energia. In generale i non metalli hanno affinità più negativa dei metalli mentre i gas nobili hanno affinità positive e non negative.L’affinità elettronica generalmente aumenta andando dal basso verso l’alto all’interno di ogni gruppo, ed andando verso destra in ogni periodo.
Questo ci permette di sostenere che l’ossigeno ha AE > AEs >AEAl
risposta corretta C
57) Il triossido di zolfo è un’anidride. In acqua si trasforma in:
A) acido solfidrico
B) acido solforoso
C) acido solforico
D) nessuno dei tre
soluzione
gli ossidi dei non metalli vengono definiti ossidi acidi proprio perchè con H2O formano acidi ossigenati. Infatti
SO2 + H2O→ H2SO3
SO3 + H2O→ H2SO4
la risposta A è da scartare perchè l’acido solfidrico non ha ossigeno infatti lasua formula è H2S
la risposta B è da scartare perchè l’acido solforoso si forma da SO2 ed H2O e non da SO3.
La risposta corretta è C
58) La vitamina D3 (colecalciferolo) viene somministrata, ai pazienti carenti, in soluzione di olio d’oliva. Si può dedurre che tale vitamina è una sostanza:
A) apolare
B) polare
C) liquida
D) nessuna delle tre
soluzione
II solventi si possono essere polari e non polari (o apolari).
La polarità di un solvente può essere misurata dalla costante dielettrica e dal momento di dipolo elettrico μ della molecola che lo costituisce. I solventi polari presentano elevati valori della costante dielettrica e del momento di dipolo, mentre i solventi non polari o apolari presentano bassi valori della costante dielettrica e del momento di dipolo.solventi polari sciolgono meglio composti polari e solventi non polari sciolgono meglio composti non polari”similia similibus solvuntur” (dal latino, “il simile scioglie il simile”). Perché un composto sia miscibile in un solvente è necessario che si formino delle forze intermolecolari composto- solvente equivalenti a quelle che esistono tra le molecole del composto.La vitamina D che vediamo in figura
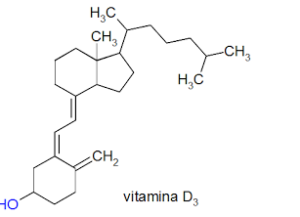
pur avendo un gruppo OH polare, nel complesso è apolare in quanto i gruppi CH3 e CH2 le conferiscono una grande liposolubilità cioè la capacità di sciogliersi nei lipidi. Siccome l’olio di oliva è una miscela di lipidi o grassi, che sono composti organici costituiti prevalentemente da Carbonio ed Idrogeno uniti tra loro con legami covalenti scarsamente polari (idrofobici) è evidente che la vitamina D si scioglie facilmente in olio d’oliva e può più facilmente essere utilizzata dall’organismo umano.
Risposta corretta A
59) Indicare qual è l’affermazione corretta tra le seguenti:
A) il KHCO3 è un sale
B) NaClO4 è un composto covalente polare
C) Hl è un composto covalente apolare
D) CaO è un anidride
soluzione
La risposta A è quella corretta in quanto KHCO3 è un sale acido formato da K+ ed HCO3-
60) Indicare in quale delle seguenti specie è presente un legame covalente dativo.
A) NH4+
B) HCO3-
C) CH4
D) N2
soluzione
Il legame di coordinazione (in passato indicato come legame covalente dativo ) è un LEGAME COVALENTE in cui una coppia di elettroni viene messa a disposizione direttamente da un solo degli atomi che formano il legame mentre l’altro atomo che contrae il legame non utilizza elettroni propri in compartecipazione ed utilizza la coppia “donata” dall’altro atomo. È da tener presente che il legame dativo, è pur sempre un legame covalente che si basa sempre su una coppia di elettroni condivisa, anche se fornita interamente da uno solo dei due atomi che si sono legati e non è un diverso tipo di legame.
Nell”ammoniaca, l’azoto presenta un doppietto elettronico libero in un orbitale ibrido SP3 e se si unisce ad uno ione H+che possiede l’orbitale 1S vuoto quindi disponibile ad accettare i 2 elettroni del doppietto dell’azoto

reagisce con esso facilmente e ne consegue che il composto NH4+ presenta un legame covalente dativo il che significa che i due elettroni del legame vengono forniti solo dall’atomo di Azoto.
Ne consegue che la risposta corretta è A
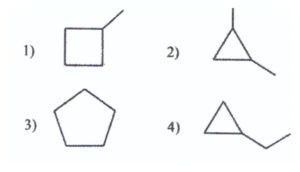
41. Quale dei seguenti cicloalcani, con formula molecolare C5H12, forma un solo prodotto di monoclorurazione quando viene riscaldato in presenza di Cl2?
A) 1
B) 2
C) 3
D) 4
soluzione
la reazione di clorurazione degli alcani e cicloalcani è un processo radicalico in cui la prima fase è la scissione del Cloro in radicali Cloro:
Cl2 → 2Cl•
un radicale attacca il carbonio in R formando il radicale R
R + Cl• → HCl + •R
che reagisce con un’altra molecola di cloro e si forma un nuovo radicale cloro che riprende il ciclo:
R• + Cl2 → RCl + Cl•
si ha pertanto una reazione a catena, in quanto uno dei prodotti del secondo passaggio costituisce il reagente del primo. La reazione procede fino a che i reagenti sono disponibili e la propagazione della reazione viene interrotta dall’accoppiamento di radicali, secondo le possibili combinazioni:
Cl• + Cl• → Cl2
R• + Cl• → RCl
R•+ •R → R-R
Negli alcani, la sostituzione di un idrogeno legato a un atomo di carbonio terziario è più facile di quella di un idrogeno legato a un atomo di carbonio secondario e questa, a sua volta, è più facile della sostituzione di un idrogeno legato a un atomo di carbonio primario.
I cicloalcani reagiscono esattamente come gli alcani .
Nei composti 1.2 e 3 le catene laterali reagiscono come sopra per formare un cloruro ma essendovi anche un C terziario si ha una clorurazione sull’anello esattamente nel C più sostituito. Ne consegue che la monoclorurazione avviene solamente col composto 3 cioè col ciclopentano.
Risposta corretta C
42) Le aldeidi e i chetoni con almeno un idrogeno sul carbonio a sono in equilibrio con le loro rispettive forme enoliche, e generahnente l’equilibrio è spostato verso la forma carbonilica. Perché nel caso dell’1,3-cicloesandione, invece, l’equilibrio è spostato verso la forma enolica?
A) La forma enolica è stabilizzata dalla coniugazione
B) La forma enolica è stericamente meno impedita
C) La forma enolica è stabilizzata da un legame a idrogeno intramolecolare
D) La forma enolica ha una maggiore reattività
soluzione
A) 45,6 g
B) 54,1 g
C) 72,5 g
D) 66,2 g
soluzione
una soluzione è isotonica rispetto ad un’ altra quando la pressione osmotica è uguale in ambedue le soluzioni. Ne consegue che la soluzione glucosata deve avere una pressione osmotica pari a π =7,75 . 105 Pa. Pertanto, essendo la pressione osmotica di una soluzione regolata dalla legge di Van’t Hoff
π=n/v RT x i
dove i rappresenta il numero di particelle presenti in soluzione
(per esempio per NaCl i=2 per MgCl2 i=3 )
nel caso del glucosio si ha i=1 perciò π x1 litro /RT = n moli di glucosio
sapendo che la temperatura media del sangue è 37 gradi C allora T=273+37
n= 7,75 . 105 x 1 /8,314 x 273+37 = 7,75 . 105 /2,58 = 3,00 moli
3,00 x 180=54,1 g di glucosio da sciogliere in 1 litro
risposta corretta B
(4) Un sistema adiabatico si espande da 1,0 m3 a 1,3 m3 contro una pressione esterna costante pari a 1,00 x 104. Pa. Qual è la variazione di energia interna?
A) ΔE = -3,0 kJ
B)ΔE = -30 kJ
C) ΔE = 30kj
D) ΔE = -40 kJ
soluzione
il primo principio della termodinamica è ΔE = Q + Lavoro
Al lavoro compiuto dal sistema per convenzione si attribuisce un valore negativo e si misura in Jaules
Nelle trasformazioni adiabatiche non c’è scambio di calore con l’esterno per cui Q=0
ΔE=L=- P(V2-V1) pertanto
L =- Pesterna (V2-V1)= – 1,00 x 104 x (1,3 -1) = -1,00 x 104 x 0,3
ΔE = -1,00 x 104 x 0,3 =3000 J = – 3,0 KJ
risposta corretta A
45) Si consideri la conversione dell’ozono in ossigeno molecolare. Se in determinate condizioni la velocità con cui si produce ossigeno è 6,0 . 10-5 mol dm-3 s-1, la velocità con cui si consuma l’ozono sarà:
A) 9,0 .10-5 mol dm-3 s-1
B) 12,0 .10-5 mol dm-3 s-1
C) 6,0 .10-5 mol dm-3 s-1
D) 4,0 .10-5 mol dm-3 s-1
soluzione
per una reazione A→ P la cinetica è v=k =-d[A]dt = d[P]/dt
pertanto se V= 6,0 .10-5 mol dm-3 s-1 che rappresenta come varia A nel tempo, essa però rappresenta anche la velocità con cui si produce B quindi
la risposta corretta è 6,0 .10-5 mol dm-3 s-1
risposta corretta C
(46) Si osserva sperimentalmente che la velocità della reazione
A →Prodotti
non cambia se varia la concentrazione di A. Qual è l’ordine di tale reazione? Quale andamento avrà la concentrazione di A al trascorrere del tempo?
A) La reazione è di primo ordine; la concentrazione dì A diminuisce linearmente
B) La reazione è di ordine zero; la concentrazione di A diminuisce linearmente
C) La reazione è di ordine zero; la concentrazione dì A non cambia
D) La reazione è di primo ordine; il logaritmo della concentrazione di A diminuisce linearmente
soluzione
sappiamo che per la reazione A→ P la cinetica è descritta da
v=k =-d[A]dt = d[P]/dt
essendo k costante (poichè non varia al variare di A) è chiaro che la velocità è del primo ordine e la concentrazione di A diminuisce proporzionalmente (linearmente ) col tempo.
risposta esatta A
47 -L’equilibrio di formazione dell’acqua
2 H2(g) + 02(g) ⇄ 2 H20(g)
si sposta a destra se la temperatura diminuisce. Si può quindi concludere che:
A) la reazione ha un ΔH maggiore di zero
B) la reazione è endotermica
C) la reazione è esotermica
D) non si può trarre alcuna conclusione in assenza di dati aggiuntivi
soluzione
in una qualunque reazione come ad es A+B ⇄ C+D.
∑ΔHprodotti – ∑ΔHregenti =ΔHreazione
se pertanto ∑ΔHprodotti > ∑ΔHregenti allora il ΔHreazione è positivo
se invece ∑ΔHprodotti < ∑ΔHregenti allora il ΔHreazione è negativo
poiché se ΔHreazione = -Q (dove Q= quantità di calore)
se ΔHreazione è negativo la reazione è esotermica cioè viene prodotto calore
se ΔHreazione è positivo la reazione è endotermica e perchè avvenga deve assorbire calore
quindi se A+B→ C +Q (ΔHnegativo ) reazione esotermica
se A+B → C -Q (ΔHpositivo ) reazione endotermica
allora nel caso della formazione dell’acqua
2 H2(g) + 02(g) ⇄ 2 H20(g)
L’entalpia di formazione è la variazione di entalpia che accompagna la formazione di una quantità di sostanza a partire dai suoi elementi.
La variazione di entalpia ΔH dipende da Temperatura,Pressione stato fisico dei reagenti e dei prodotti ( solido, liquido, gassoso, acquoso).
Naturalmente se la reazione avviene con produzione di calore (esotermica)
A+B→C +Q
un aumento di calore Q sposta l’equilibrio verso sinistra mentre una sottrazione di calore (temperatura più bassa) sposta l’equilibrio verso destra.
ovviamente se la reazione avviene con assorbimento di calore (endotermica)
A+B →C -Q
è evidente che l’aumento di calore Q sposta l’equilibrio verso destra
Pertanto se la temperatura diminuisce la reazione e l’equilibrio si spostano a sinistra
da quanto detto, per la reazione del quesito, e poichè la diminuzione di temperatura provoca uno spostamento verso destra della reazione, allora la reazione è Esotermica.
Risposta corretta C
48) Alla temperatura di 300 K e alla pressione P T’ la costante di equilibrio per la reazione:
N2(g) +O2 (g) ⇄ 2NO(g)
è Kp . Se la reazione si scrive nel modo che segue:
½N2(g) + ½O2(g) ⇄ NO(g)
la costante di equilibrio sarà espressa come:
A) (Kp)½
B) Kp
C) Kp²
D) Kpx PT
soluzione
il valore della costante di equilibrio per una reazione gassosa dipende dalle pressioni parziali dei componenti la reazione per cui per la reazione allo stato gassoso
N2(g) +O2 (g) ⇄ 2NO(g) Kp1 =P²NO / PN2 x PO2
e per la reazione che è sempre allo stato gassoso,
½N2(g) + ½O2(g) ⇄ NO(g) Kp= PNO /P½N2 x P½O2
da cui si osserva che Kp =(Kp)½
ne consegue che la risposta corretta è A
49) Quale delle soluzioni indicate ha la concentrazione di ioni Ag+ (aq) maggiore?
A) Soluzione satura di AgCl(s) Kps=1,8 10-10
B) Soluzione satura di Ag2SO4(s) Kps= 1,7 10-5
C) Soluzione 0,015 M di AgNO3
D) Soluzione satura di AgCN(s) Kps=1,2 10-16
soluzione
in AgCl [Ag+]= √Kps = 1,34 x 10-5 moli/l
inAg2SO4 Kps=( 2s)² x s =4s³ s³=[Ag+]³ = KPs/4 =1,7 x 10-5 /4
s= 0,0162 moli/l
in AgNO3 0,015 M [Ag+]=0,0150 moli/l
per AgCN [Ag+]= √Kps =√1,2 10-16 = 1,0 x 10-8 moli/l
da quanto esposto la [Ag+] maggiore è quella di Ag2SO4
50) Calcolare il pH di una soluzione ottenuta disciogliendo 0,015 mol di HCl e 0,030 mol di NaNO3 in acqua e portando il volume a 0,50 L
A) 2,2
B) 3,3
C) 4,3
D) 4,9
soluzione
l’aggiunta di acido 0,015 moli di HCl a 0,03 moli di sale NaNO2 forma HNO2 il quale è ancora in presenza di sale NaNO2 , ciò significa che si è formato un tampone costituito dall’acido debole HCN in presenza del suo sale NaCN.
HNO2<=> H+ + NO2- Ka= [H+] [NO2-] / [HNO2]
ma [NO2-] = concentrazione del sale NaNO2
[HNO2] = concentrazione dell’acido HNO2 il cui H+ proviene dall’HCl aggiunto quindi [HNO2]= conc HCl
pertanto [H+] = Ka x Ca/Cs PH = PKa + logCs/Ca
quindi PH= -log 4,5 x 10-4 + log 0,03/0,015= 4-log 4,5 +log 2 = 4- 0,65 + 0,30 =3,3
PH= 3,3
risposta corretta B
51) Quanti grammi di acqua devono evaporare da 80,0 g di una soluzione al 37,0% in peso di KBr, per ottenere una soluzione al 55,0%?
A) 34,3 g
B) 12,8g
C) 11,7 g
D) 26,2 g
soluzione
in 80 g vi sono 0,37 x80, all0ra in (80-X) ve ne sono 0,55 x (80-x)
pertanto 80 x 0,37 =0,55x (80-X)
29,6 = 44-0,55X da cui 0,55X = 44-29,6 0,55X = 14,4 X=14,4/0,55 =26,18 g
risposta corretta D
52) Alla temperatura di 293 K, in 250 mL di soluzione acquosa sono disciolti 0,019 g di N2(g) nelle condizioni in cui la pressione parziale di N2(g) sulla soluzione è 1,01×105 Pa, Calcolare la costante (in unità Pa/M) relativa all’ equilibrio:
N 2(aq) <=> N 2(g)
A) 4,11 x 106 Pa/M
B) 1,55 x 105 Pa/M
C) 3,73 x 107 Pa/M
D) 8,44 x 107 Pa/M
soluzione
la costante di equilibrio per la reazione N 2(aq) <=> N 2(g) è:
[N2]g /[N2]aq =K
[N2]aq=( 0,019/28 )/Volume = 0,000678 / 0,250 = 0,00271 moli/l
[N2]g = pressione parziale di N2 =1,01 x 105 Pa
quindi K= 1,01 x 105 /0,00271 =3,726 x 107
risposta corretta C
53) Calcolare il pH di una soluzione ottenuta mescolando:
100,0 ml, di NH4Cl(aq) 0,020 M con 20,0 mL di HCl(aq) 0,030 M e 50,0 mL di NaOH(aq) 0,052 M. Considerare i volumi additivi.
A) 10,7
B) 12,5
C) 7,21
D) 9,15
soluzione
l’aggiunta di NaOH ad NH4Cl forma un tampone costituito da NH4Cl ed NH4OH
Un tampone è una soluzione che varia in maniera trascurabile il proprio pH in seguito all’aggiunta di quantità moderate di un acido o di una base forte come nel caso del quesito. Per il calcolo del PH si applica poi l’equazione di Henderson-Hasselbalch
PH=PKa + log Cs/Cb
Ka= Kw/Kb = 1.0×10-14/1.8×10-5 = 5.6×10-10
Cs= 100 x 0,020 = 2millimoli in un volume pari a 100 +50 = 2 mmoli in 150ml
Cb= 50 x 0,052 =2,6 mmoli in 150 ml
se in 150ml vi sono 2,6 x 10-3 moli in 1000 ve ne sono x
x=Cb=2,6 /150 = 0,0174 moli/l
Cs = 2/150 = 0,013 moli/l PH = -log 5,6 x 10-10 + log 0,013/0,0174
PH= 10-log 5,6 + log 0,747 =10-0,748 -0,126 =9,126
se aggiungiamo 20 ml HCl 0,03 M abbiamo
[H+]= 10-9,126 + ( 20 x 0,03)/170 = 1,0035 x 10-9,126
PH = 9,126 -log 1,0035 =9,126-0,0015 = 9,1476 = 9,13
54) A 1000 K avviene la reazione che segue (da bilanciare):
NH3(g) + NO (g)→ N2(g) + H2O (g)
Quante moli di N2(g) si ottengono se si mettono a reagire 15,3 mol di NO(g) e 8,5 moli di NH3(g)?
A) 12,1 mol
B) 11,2 mol
C) 13,1 mol
D) 10,6 mol
soluzione
l reazione bilanciata è: 4NH3(g) +6 NO (g)→5 N2(g) + 6H2O (g)
pertanto se 4 moli di NH3 formano 5 moli di N2, allora 8,5 moli ne formeranno X
4:5=8,5 :X X= 8,5×5/4= 10,6 moli
risposta corretta D
55) Mettendo a reagire 2,00 mol di azoto con una quantità stechiometrica di idrogeno, ad alta temperatura, si forma ammoniaca. Calcolare il numero di moli di tutte le specie presenti alla fine della trasformazione, se la reazione ha una resa del 75%.
A) 1,0 mol di N2; 3,0 mol di H2; 2,0 mol di NHs
B) 0,5 mol di N2; 1,5 mol di H2; 3,0 mol di NH,~
C) 0,7 mol di N2; 0,21 mol di H2; 1,75 mol di NH3
D) 0,25 mol di N2; 0,50 mol di H2); 3,0 mol di NH3
soluzione
la reazione bilanciata è. N2 + 3H2→ 2NH3
per cui da 2 moli si avrà 2N2 +6H2→ 4NH3
ma la resa è il 75% quindi in realtà si formano 4x 0,75 = 3,0 moli si NH3
ovviamente 2 – 0,75 x 2 =0,5 sono le moli di N2
e quindi 6-0,75x 6 =1,5 moli di H2
risposta corretta D
56) Nella struttura di Lewis dello ione NO3-la carica formale sull’azoto è :
A) 0
B) +1
C) +2
D) +3
soluzione
La carica formale è la carica che viene attribuita ad un atomo in una molecola o ione molecolare presumendo che gli elettroni dei suoi legami con gli altri atomi siano equamente condivisi senza tener conto dell’elettronegatività.
La carica formale può essere utile per stabilire quale fra le possibili strutture di Lewis rappresenta meglio i legami della molecola.
Carica formale = ( numero di elettroni di valenza dell’atomo neutro) – (numero degli elettroni di valenza di non legame dell’atomo nella molecola) – ½ ( numero di elettroni presenti nei legami covalenti).
C.F.= Evalenza – EnoBonding– ½Nelet.Bonding
Per l’azoto in NO3- si ha
57) Indicare in base della teoria VSEBR, quale delle due specie, SF 4 e NH. +, ha una geometria a sella:
A) solo SF4
B) solo NH4+
C) ambedue le specie
D) nessuna delle due specie
soluzione
NH4+ ha struttura tetraedrica
SF4
In SF4 Lo zolfo ha un totale di sei elettroni di valenza e due formano una coppia non condivisa (lone pair). Secondo la teoria VESPR si può prevedere che la forma della molecola sia a sella con S al centro.
La coppia di elettroni non condivisa occupa una posizione equatoriale. Nella molecola sono presenti due tipi diversi di leganti F: due F sono assiali e due sono equatoriali. Le distanze di legame sono S–Fax = 164.3 pm e S–Feq = 154.2 pm. : i leganti in posizione assiale sono legati più debolmente.
Lo spettro NMR al 19F di SF4 presenta un solo segnale, indicando che le posizioni degli atomi di fluoro equatoriali e assiali si interconvertono rapidamente con un meccanismo di pseudorotazione.
La risposta corretta è A
58) La reazione tra zinco e acido solforico produce solfato di zinco e idrogeno gassoso. Calcolare quanti grammi di solfato di zinco si producono se si formano 28,0 litri di H2 misurato a 273,15 K e 101,3 kPa.
A) 202,0 g
B) 404,0 g
C) 606,0 g
D) 134,7 g
soluzione
la reazione è Zn+H2SO4 → ZnSO4 +H2↑
28 litri di H2 alla T=273,15 e P=101,3 kPa sono n moli
PV=nRT n=PV/RT
n= 101,3 x 28 /8,314 x 273,15 =1,25 moli
le moli di ZnSO4 che si ottengono dalla reazione sono uguali alle moli di idrogeno quindi si ottengono 1,25 moli di ZnSO4 cioè
1,25 x PM = gr 1,25 x 161,4 =201,75 g
risposta corretta A
59) ANNULLATO
60) Calcolare quanti grammi di Ca3(PO4)2 si ottengono se si mettono a reagire 22 g di k3PO 4 con 12 g di CaCl2. La reazione (da bilanciare) è:
K3PO4(aq) + CaCl2(aq) →Ca3(PO4)2(s) + KCl(aq)
A) 44g
B) 33 g
C) 22 g
D) 11 g
soluzione
la reazione bilanciata è :
2K3PO4(aq) + 3CaCl2(aq) →Ca3(PO4)2(s) + 6KCl(aq)
se da 3 CaCl2 si ottiene Ca3(PO4)2 da 12 g se ne ottiene X
3x 111 : 310,2 = 12 :X
333 : 310,2=12 :X X = 11,18 g