ELEMENTI
Gennaio 21, 2023Se cerchiamo di scindere un composto con metodi chimici notiamo che si ottengono sostanze più semplici. Se adesso cerchiamo di scindere le sostatnze semplici ottenute notiamo che NON è più possibile ottenere sostanze semplici diverse da quelle che cerchiamo di trasformare. Facciamo un esempio: cerchiamo di scindere l’acqua (H2O) utilizzando la corrente elettrica. Notiamo che si ottengono due sostanze più semplici cioè H (idrogeno) ed O (ossigeno) che inizialmente uniti formavano H2O cioè l’acqua.Adesso, per quanto tentiamo di ottenere dall’ idrogeno o dall’ ossigeno altre sostanze più semplici, NON riusciremo che ad ottenere SEMPRE idrogeno o ossigeno, cioè le sostanze semplici saranno sempre idrogeno ed ossigeno. Diciamo allora che IDROGENO ED OSSIGENO SONO SOSTANZE SEMPLICI TUTTE DELLA STESSA SPECIE CIOE’ SONO SOSTANZE PURE.
LE SOSTANZE PURE COSTITUITE DA UNA SOLA SPECIE VENGONO CHIAMATE ELEMENTI
PERTANTO NELL’ESEMPIO RIPORTATO SOPRA, L’IDROGENO E L’OSSIGENO SONO SOSTANZE SEMPLICI PURE CHE CHIAMIAMO ELEMENTI.
QUINDI ALLA DOMANDA ; “COSA E’ UN ELEMENTO?” BISOGNA RISPONDERE:
UN ELEMENTO E’ UNA SOSTANZA PURA COSTITUITA DA PARTICELLE DELLA STESSA SPECIE E DA CUI NON E’ POSSIBILE OTTENERE IN ALCUN MODO SOSTANZE PURE DIVERSE.
Si conoscono ad oggi 118 elementi di cui 89 riscontrabili in natura ma i restanti 29 sono stati costruiti in laboratorio mediante reazioni nucleari.
LE PARTICELLE DELLA STESSA SPECIE CHE COSTITUISCONO UN ELEMENTO VENGONO CHIAMATE ATOMI.
COME E’ FATTO UN ATOMO?
Tutti gli atomi di tutti gli elementi conosciuti possiedono la stessa struttura come se ogni atomo occupasse una casa popolare di un villaggio costituito da appartamenti tutti uguali. Ovviamente, continuando con l’analogia, le famiglie che abitano nelle case popolari si distinguono per numero di persone che vi abitano, infatti la famiglia pincus è costituita da genitori e 1 figlio, la famiglia pallinus da genitori e 2 figli ecc.
ma come è fatto un atomo?
Un atomo è fondamentelmente una struttura quasi vuota in cui vi è una parte centrale chiamata NUCLEO dove risiede quasi tutta la massa dell’atomo formato da particelle dette PROTONI ogniuna delle quali ed è dotata di CARICA ELETTRICA POSITIVA (convenzionalmente indicata con + 1). Il numero di protoni in un nucleo è caratteristico di ogni atomo. Oltre ai protoni, il nucleo possiede anche particelle delle stesse dimensioni e con ugual massa dei protoni e che sono chiamate NEUTRONI perchè al contrario dei protoni NON possiedono una carica elettrica.
IL NEUTRONE, OVVIAMENTE, AVENDO LA MASSA UGUALE A QUELLA DEL PROTONE FA AUMENTARE LA MASSA COMPLESSIVA DELL’ATOMO MA NON NE MODIFICA LE CARATTERISTICHE CHIMICHE.
All’esterno del nucleo vi sono piccolissime particelle chiamate ELETTRONI che possiedono carica elettrica negativa convenzionalmente indicata con -1 e che si muovono in modo casuale intorno al nucleo del quale risentono l’attrazione elettrica.
Il numero di elettroni in un atomo è sempre uguale al numero di protoni dando origine ad un atomo elettricamente neutro
n PROTONI + n ELETTRONI—–> ATOMO NEUTRO
uno stesso atomo che presenta nel nucleo oltre ai protoni anche i neutroni viene definito ISOTOPO dell’atomo.
Per esempio IN NATURA TROVIAMO L’ELEMENTO CHIMICO IDROGENO il cui simbolo chimico è H che possiede un protone ed un eletrone ed ha carica NEUTRA.
ESISTE PERO’ IN NATURA (ANCHE SE IN QUANTITA’ PIU’ PICCOLE RISPETTO AD H ) UN ATOMO DI IDROGENO CHE POSSIEDE UN PROTONE UN ELETTRONE MA ANCHE UN NEUTRONE. QUESTO ATOMO DI IDROGENO E’ CHIAMATO DEUTERIO E SI INDICA CON D (INFATTI FORMA LA COSIDDETTA ACQUA PESANTE D2O )
ESISTE ANCHE UN TERZO ATOMO DI IDROGENO QUESTA VOLTA CON DUE NEUTRONI (IN QUESTO CASO OLTRE CHE ESSERE PIU’ PESANTE DEI PRECEDENTI E’ ANCHE RADIOATTIVO) E VIENE CHIAMATO TRITIO E SI INDICA CON T.
Sia il DEUTERIO che il TRITIO sono chiamati ISOTOPI DELL’IDROGENO.
Si tratta infatti nei due casi di IDROGENO CHE NEL NUCLEO POSSIEDE NON SOLO IL PROTONE DELL’IDROGENO MA ANCHE UN NEUTRONE (DEUTERIO) O DUE NEUTRONI (TRITIO) E DIFFERISCONO DALL’ IDROGENO ESCLUSIVAMENTE PER AVERE UNA MASSA DIFFERENTE.
l’ATOMO DI IDROGENO SI RAPPRESENTA CON UN SIMBOLO CHE NEL CASO DELL’IDROGENO E’ H
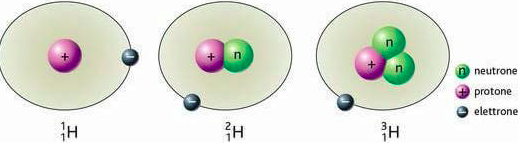
COME VEDI ABBIAMO SCRITTO IL NUMERO TOTALE DATO DALLA SOMMA
PROTONI + NEUTRONI IN ALTO A SINISTRA
MENTRE IL SOLO NUMERO DI PROTONI ( CHE E’ UGUALE AL NUMERO DI ELETTRONI ESSENDO L’ATOMO ELETTRICAMENTE NEUTRO) LO SCRIVIAMO IN BASSO A SINISTRA.
LA SOMMA PROTONI + NEUTRONI = NUMERO DI MASSA
IL NUMERO DI PROTONI (O ELETTRONI) = NUMERO ATOMICO
PER UN GENERICO ATOMO X RAPPRESENTIAMO QUANTO SOPRA NEL MODO SEGUENTE :
Risulta semplice calcolare quanti NEUTRONI possiede un atomo facendo la differenza
numero neutroni= numero di massa – numero atomico.
ALCUNI ATOMI CHE IN NATURA HANNO ISOTOPI
l’ossigeno in natura esiste nelle tre forme:
16O 8 protoni ed 8 neutroni abbondanza paria a 99,759 %
17O 8 protoni e 9 neutroni abbondanza pari a 0,0374%
18O 8 protoni e 10 neutroni abbondanza 0,2039 %
il cloro a sua volta esiste nelle due forme
35 Cl 17 protoni e 18 neutroni abbondanza pari a 75,77%
37Cl 17 protoni e 19 neutroni abbondanza pari a 24,23 %
il bromo ha due isotopi:
79Br 35 protoni e 44 neutroni abbondanza pari a 50,54%
81Br 35 protoni e 46 neutroni abbondanza pari a 49,46%
ESERCIZI
1)
INDICA QUANTI PROTONI NEUTRONI ED ELETTRONI SONO PRESENTI NEI SEGUENTI ATOMI:
12C 208 Pb 13C 96 Mo 116Cd
per calcolare il numero di neutroni ricordiamo che il carbonio Z=6 possiede 6 elettroni (ed ovviamente 6 protoni essendo elettricamente neutro) mentre il numero di massa A =12 perciò il 12C possiede 12- 6 =6 quindi possiede:
6 neutroni, 6 protoni e 6 elettroni.
il 208 Pb possiede Z= 82 elettroni e numero di massa A= 208 perciò il numero di protoni è : 208- 82 =126 neutroni ed ovviamente 82 protoni
il 13C ha numero di massa A= 13 ma Z=6 (numero di elettroni o protoni) perciò possiede 13-6 = 7 neutroni
il Molibdeno 96 Mo possiede numero di massa A=96 e Z= 42 elettroni (o protoni) perciò possiede 96-42 neutroni
Il cadmio= 116Cd possiede numero di massa A=116 e Z=48 elettroni (o protoni) pertanto possiede 116-48 =68 neutroni
2) INDICARE QUANTI ELETTRONI PROTONI E NEUTRONI POSSIEDONO I SEGUENTI IONI:
K+ (Z=19 A=19 ) Ti+3 (Z= 22 A=48) Cd+2 ( Z=48 A= 112) Cl– (Z=17 A= 35)
Se-2 (Z=34 A= 80)
SOLUZIONE
K+ HA UNA CARICA POSITIVA E CIO’ SIGNIFICA CHE HA PERSO UN ELETTRONE MENTRE IL NUMERO DI PROTONI RIMANE INVARIATO PERCIO’ IL NUMERO DI PROTONI E’ INDICATO DA Z=19 MENTRE IL NUMERO DI ELETTRONI E’
19-1 =18 ed I NEUTRONI SONO 19-19=0
LO IONE TITANIO Ti+3 (Z= 22 A=48) HA 3 ELETTRONI (CARICHE NEGATIVE ) IN MENO PER CUI POSSIEDE
22 PROTONI
22-3 = 19 ELETTRONI
A-Z NEUTRONI CIOE’
48-22 =26 NEUTRONI
LO IONE CADMIO Cd+2 ( Z=48 A= 112) AVENDO 2 CARICHE POSITIVE EVIDENTEMENTE HA 2 ELETTRONI IN MENO RISPETTO AI PROTONI PERCIO’
GLI ELETTRONI SONO 48 -2 =46
PROTONI = 48
NEUTRONI 112 -48 = 64
LO IONE CLOROCl– (Z=17 A= 35)POSSIEDE UNA CARICA NEGATIVA E CIO’ SIGNIFICA CHE HA UN ELETTRONE IN PIU’ RISPETTO AI PROTONI PERCIO’
PROTONI=Z=17
ELETTRONI = Z+1 =18
NEUTRONI = A-Z= 35-17 =18
FINE ESERCIZI E RIPRENDIAMO LA NOSTRA CHIACCHERATA .
ESSENDO L’ATOMO FORMATO DA PROTONI (CARICA POSITIVA) E DA ELETTRONI (CARICA NEGATIVA)
sorge spontanea una domanda
PERCHE’ GLI ELETTRONI NON CADONO SUL NUCLEO VISTO CHE CARICHE DI SEGNO OPPOSTO SI ATTRAGGONO?
SPIEGAZIONE
Un fisico di nome Niels Bohr nel secolo scorso riferendosi all’atomo più semplice che è l’idrogeno ( 1 protone ed 1 elettrone) ipotizzò che l’elettrone non cade sul nucleo perchè sosteneva che percorresse orbite circolari intorno ad esso come i pianeti intorno al sole senza tuttavia perdere energia (contrariamente a quanto dovrebbe succedere a causa dell’attrito secondo la fisica sino ad allora conosciuta ).
Quindi l’energia dell’elettrone secondo Bohr rimane sempre uguale se percorre la stessa orbita.
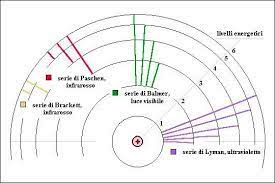
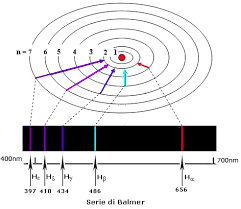
Questo riusciva a spiegare uno dei problemi sino ad allora irrisolti e cioè il fatto che l’atomo di idrogeno eccitato con un arco voltaico producesse su una lastra fotografica gruppi di righe dovute alle radiazioni luminose emesse e che altri fisici avevano scoperto. Infatti si conoscevano serie di righe scoperte dai fisici Lyman (serie di Lyman), Balmer (serie di Balmer), Paschen (serie di Paschen) Brakett (serie di Brakett),Pfund(serie di Pfund) con le lunghezze d’onda relative ad ogni riga ottenuta. Ogniuno dei fisici aveva calcolato le lunghezze d’onda delle righe ottenute utilizzando formule sperimentali senza alcuna base teorica.
Bohr teorizzò che per effetto dell’eccitazione con l’arco voltaico l’elettrone acquistasse energia e passasse su orbite successive con energia maggiore. Una volta finita l’eccitazione, l’elettrone ritornava al livello energetico inferiore emettendo una radiazione relativa alla differenza tra i due livelli energetici.
Quindi la serie di Lyman era dovuta al salto dell’elettrone dalla prima orbita alla seconda, terza, quarta ecc.,la serie di Balmer era dovuta al salto dalla seconda orbita alla terza,quarta, quinta ecc la serie di Paschen era dovuta al salto tra la terza orbita e la quarta,quinta, sesta ecc la serie di Brakett era dovuta al salto dalla quarta orbita alla quinta,sesta ecc la serie di di Pfund era dovuta al salto tra la quinta orbita e la sesta,settima ecc
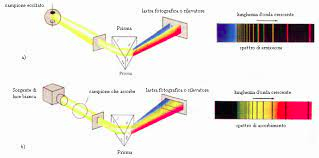
a sinstra c’è l’arco voltaico che eccita l’idrogeno, la luce emessa viene fatta passare attraverso una fenditura e poi un prisma che distanzia le onde luminose creando le varie righe sulla lastra fotografica.
Pochè Bohr calcolò l’energia dell’elettrone En per ogni orbita n utilizzando un’equazione matematica detta equazione di Scrodingher ed essendo la lunghezza d’onda pari alla differenza di energia delle orbite (ad es E2 – E1 = h × λ/C dove h è la costante di Plank λ la lunghezza d’onda della riga emessa e C la velocità della luce) Bohr calcolò le lunghezze d’onda di ogni riga appartenente ad ogni serie conosciuta.
LA DOMANDA CHE ADESSO CI DOBBIAMO FARE E’:
MA PERCHE’ LA TEORIA DI BOHR CHE E’ RIUSCITA A SPIEGARE L’ORIGINE DELLE RIGHE (DETTE RIGHE DELLO SPETTRO DELL’IDROGENO) E’ STATA ABBANDONATA?
Partiamo da un semplice paragone con il pianeta terra che ruota attorno al sole.
Conosciamo la velocità con cui essa si muove quindi conosciamo il momento cioè la sua quantità di moto data dal prodotto massa x velocità e possiamo anche facilmente prevedere con un semplice calcolo quale posizione assumerà dopo un certo periodo di tempo. Da quanto detto, secondo la teoria di Bohr dovremmo poter prevedere contemporaneamente l’energia dell’elettrone (quantitàdi moto mv) e la sua posizione. E’ stato però dimostrato da Heisenberg che è impossibile ottenere contemporaneamente dati esatti di energia e posizione di un elettrone in quanto, se calcoliamo con precisione la quantità di moto commettiamo un errore nel calcolo della posizione e viceversa ed ha calcolato che il prodotto tra l’errore nel calcolo della quantità di moto e l’errore nel calcolo della posizione è pari in valore all’incirca alla costante di Plank cioè
Δx × Δp= 6,62618·10-34 J·s./2π
Questo. a livello atomico l’osserviamo sempre, perchè per poter fare un’osservazione su una particella qualsiasi dobbiamo usare uno strumento il quale perturba più o meno il nostro sistema durante la misura e quindi possiamo dire che per il principio di Heisenberg DETTO PRINCIPIO DI INDETERMINATEZZA E’ IMPOSSIBILE CHE L’ELETTRONE POSSA MUOVERSI IN ORBITE CIRCOLARI.
MA ALLORA COME POSSIAMO DESCRIVERE L’ELETTRONE CHE SAPPIAMO CERTAMENTE CHE SI MUOVE ATTORNO AL NUCLEO?
LA RISPOSTA E’ :
SOLAMENTE IN TERMINI DI PROBABILITA’
Per comprendere come sia possibile, facciamo un esempio semplicissimo. Immagina che l’elettrone sia un elicottero fermo nell’aria in un certo punto.Questo punto è facilmente individuabile indicando la latitudine,la longitudine e l’altezza dal suolo a cui si trova l’elicottero quindi la sua posizione è funzione della latitudine,longitudine ed altezza dal suolo.
Se supponiamo di dover individuare la posizione dell’elettrone fermo in un punto dello spazio intorno al nucleo dobbiamo utilizzare un sistema di assi cartesiani x,y,z CHE HANNO LA STESSA FUNZIONE DELLA LATITUDINE,LONGITUDINE ED ALTEZZA PER L’ELICOTTERO VISTO POCO SOPRA.
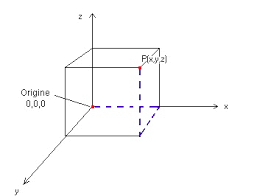
IL PUNTO P E’ INDIVIDUATO DAI VALORI DI X.Y.Z.
NEL CASO DELL’ELETTRONE ESSO VIENE DESCRITTO ANZICCHE’ CON P CON LA LETTERA GRECA PSI Ψ.
Possiamo quindi descrivere la posizione dell’elettrone dai valori di x,y,z : ciò dal punto di vista matematico è lo stesso che dire :
la posizione dell’elettrone è descritta dalla funzione matematica Ψ(x,y,z).
Adesso supponi di posizionarti con una sedia a sdraio sul nucleo dell’atomo cioè all’origine degli assi cartesiani. Scegli un punto dello spazio intorno a te (che sei sul nucleo) un punto descritto dalle coordinate X1, Y1 , Z1 CIOE’ IL PUNTO
Ψ(x1, y1 , z1)
sapendo che l’elettrone sicuramente si trova intorno al nucleo e si muove velocemente in modo del tutto casuale, osserva quante volte su 100 passa dal punto che hai scelto.
Supponiamo che da quel punto passi 2 volte su 100 cioè
Ψ(x1, y1 , z1) = 2/100 = 0,02
sappiamo che se eleviamo al quadrato la funzione Ψ(x1, y1 , z1) se cioè facciamo il calcolo
Ψ2(x1, y1 , z1) = (0,02)2
otteniamo la probabilità che l’elettrone si trovi nel punto caratterizzato da Ψ(x1, y1 , z1).
Adesso immagina di scegliere ogni volta un punto diverso intorno al nucleo e di ripetere ciò che abbiamo visto poco sopra : otterrai un valore di probabilità elevando al quadrato la funzione Ψ(xi,yi,zi) dove i varia milioni di volte(cioè scegli milioni di punti).
Se sommiamo tutti i valori delle probabilità ottenute in tutto lo spazio intorno al nucleo è ovvio che nell’insieme dei punti troveremo il 100 % di probabilità essendo certi che l’elettrone sia presente e si muova come abbiamo visto intorno al nucleo pur non preferendo particolarmente un singolo punto.
Il 100% di probabilità quindi corrisponde a 100/100=1 e pertanto la somma delle probabilità calcolate per ogni punto è pari ad 1. Indicando il simbolo di somma con il segno ∫ possiamo scrivere
∫ Ψ2(x1, y1 , z1) dt =1
Questa formula ci dice che la somma delle probabilità nello spazio intorno al nucleo (indicato con dt) è necessariamente 1.
La funzione Ψ viene chiamata funzione orbitale tuttavia nella pratica chimica il termine ORBITALE si riferisce alla densità elettronica calcolata con opportuni metodi. Gli orbitali possiedono densità che possono essere a simmetria sferica (indicati con la lettera S) o orientati nello spazio secondo assi cartesiani (questi tipi di densità elettronica vengono indicati con la lettera P oppure d o f).
Di seguito sono rappresentati i vari tipi di orbitali atomici
Possiamo riassumere dicendo che l’atomo è costituito da un nucleo positivo e da elettroni che ruotano intorno al nucleo. Il calcolo effettuato con l’idrogeno che è il più semplice degli atomi ci dimostra che man mano che ci allontaniamo dal nucleo vi sono i seguenti orbitali
1S 2S 2Px2Py2Pz 3S 2Px3Py3Pz 3d1 3d2 3d3 3d4 3d5 4S 4Px4Py 4Pz 4d1 4d2 4d3 4d4 4d5 4f1 4f2 4f3 4f4 4f5 4f6 4f7
l‘energia di questi orbitali aumenta dall’1S ai 7 orbitali f con una sola eccezione: l’orbitale 4S possiede energia più bassa degli orbitali 3d .
SIAMO GIUNTI PERTANTO A CAPIRE COME E’ COSTITUITA LA STRUTTURA DI UN ATOMO. SI TRATTA ADESSO DI CONOSCERE COME I VARI ATOMI SISTEMANO I PROPRI ELETTRONI NEGLI ORBITALI.( RICORDI CHE GLI ATOMI SI DISTINGUONO PER IL LORO DIVERSO NUMERO DI ELETTRONI?).
Gli atomi sistemano gli elettroni a due a due in ogni orbitale ( tranne che negli orbitali P che vengono riempiti prima singolarmente e poi in coppia).
Prendiamo in considerazione l’atomo di idrogeno: possiamo rappresentarlo col suo simbolo H oppure indicando che l’unico elettrone che possiede si trova nell’orbitale 1S il più vicino al nucleo, quindi possiamo indicarlo con 1S1 possiamo anche indicare l’orbitale 1S come un quadrato e gli elettroni con delle frecce orientate verso l’alto o verso il basso.
quindi i tre modi di rappresntare l’idrogeno sono:
IDROGENO
simbolo H
struttura 1S1
| ↑ |
1S
L’ELIO simbolo He possiede 2 elettroni quindi possiamo scriverlo
simbolo He
struttura elettronica 1S2
| ↑↓ |
1S
in questo caso i 2 elettroni che occupano l’orbitale sono indicati da 2 frecce con orientamento opposto per far comprendere che uno degli elettroni ruota su se stesso(spin) verso destra e l’altro verso sinistra.
consideriamo il CARBONIO che possiede 6 elettroni allora si riempiranno con 2 elettroni sia 1S che 2 S e gli altri due si sistemano singolarmente uno sul 2Px l’altro sul 2Py (ricorda che quando si devono occupare orbitali con la stessa energia cioè degeneri essi vengono prima occupati singolarmente per la massima molteplicità di Hund) .pertanto
Carbonio
simbolo C
struttura elettronica 1S2 2S2 2Px1 2Py1
1S2 2S2
| ↑↓ | ↑↓ |
| ↑ | ↑ |
px 1 py 1 pz
consideriamo l’azoto N che possiede 7 elettroni si avrà allora
simbolo N
struttura elettronica 1S2 2S2 2Px1 2Py1 2Pz1
| ↑↓ | ↑↓ |
| ↑ | ↑ | ↑ |
px 1 py 1 pz
consideriamo l’ossigeno O con 8 elettroni
O 1S2 2S2 2Px2 2py1 2pz1
| ↑↓ | ↑↓ |
| ↑↓ | ↑ | ↑ |
px 1 py 1 pz
prima si riempiono singolarmente i 3 orbitali 2P poi l’ultimo elettrone va ad occupare il 2Px accoppiandosi con spin diverso.
DA QUANTO SOPRA ADESSO SEI IN GRADO DI RAPPRESENTARE QUALUNQUE ATOMO SE CONOSCI IL NUMERO DI ELETTRONI(OVVIAMENTE UGUALE AL NUMERO DI PROTONI)
numero si massa(P+N)
X
numero elettroni (o P)
IL NOME DEGLI ATOMI
Tutti gli atomi hanno un nome che per semplicità è indicato da un simbolo . Il simbolo in genere si forma dalle prime due lettere del nome oppure ,per alcuni, dal loro nome latino o greco. Per esempio l’ elemento CALCIO ha SIMBOLO Ca , l’elemento BROMO ha SIMBOLO Br, l’elemento CLORO ha SIMBOLO Cl. l’elemento CROMO ha simbolo Cr, il COBALTO ha simbolo Co l’alluminio ha SIMBOLO Al, il litio Li , FERRO Fe, Berillio Be
Alcuni elementi sono però costituiti da una sola lettera come ad es.
CARBONIO che ha simbolo C OSSIGENO che ha simbolo O, BORO B
TUTTAVIA SE LE PRIME DUE LETTERE DEL NOME SONO UGUALI PER PIU’ DI UN ATOMO, ES MAGNESIO E MANGANESE ALLORA IL SIMBOLO E’ FORMATO DALLA PRIMA E DALLA TERZA LETTERA OPPURE DALLA PRIMA E LA SECONDA PER UNO E DALLA PRIMA E TERZA PER L’ALTRO ES .
MAGNESIO Mg MANGANESE Mn
CERIO Ce CESIO Cs
STAGNO (stannum) Sn STIBIUM (antimonio) Sb
Come ho detto sopra, alcuni atomi hanno il simbolo che deriva dal nome latino o greco per esempio
IDROGENO SIMBOLO H ( che deriva dal greco Hydor ghennao che significa generatore di acqua)
SODIO SIMBOLO Na ( da Natrium nome latino della SODA che i latini ottenevano dalle ceneri di una pianta chiamata Salsola )
AZOTO SIMBOLO N ( dal greco “nitrogeno”, nítron, “salnitro”, e ghennáo, “generare”: “generatore di SALNITRO”)
FOSFORO SIMBOLO P ( dal greco Phos luce e phoros portatore cioè portatore di luce)
ZOLFO SIMBOLO S (dal latino Sulphur zolfo che i latini estraevano soprattutto in sicilia)
POTASSIO SIMBOLO K (dal latino Kalium residuo dell’incenerimento di vegetali)
RAME SIMBOLO Cu ( da cuprum metallo o lega di rame che si otteneva dall’isola di Cipro )
ORO SIMBOLO Au ( dal latino aurum)
TUNGSTENO SIMBOLO W ( dal termine wolframite un minerale da cui si estrae)
MERCURIO SIMBOLO Hg ( da Hydrargirium da Hydor e girium argento liquido )
QUANDO AD UN ATOMO, CHE E’ SEMPRE ELETTRICAMENTE NEUTRO (CIOE’ CON CARICHE POSITIVE SUL NUCLEO [DETTE PROTONI ] E CARICHE NEGATIVE INTORNO AL NUCLEO [ELETTRONI] IN QUANTITÀ UGUALI ), VENGONO TOLTE UNA O PIU’ CARICHE NEGATIVE CIO’ CHE RIMANE E’ UN ATOMO CON UNA O PIU’ CARICHE POSITIVE CIOE’ UN CATIONE. SE INVECE SONO PREPONDERANTI LE CARICHE NEGATIVE ALLORA SI HA UN ANIONE.
ESERCIZIO 1
K+ si chiama
- anione Potassio
- elemento potassio
- catione potassio
- sale di potassio
soluzione
si tratta dell’elemento potassio cui è stato tolto 1 elettrone (carica negativa) . Il potassio, atomo elettricamente neutro, perdendo una carica negativa rimane con una carica positiva in più perciò il nome corretto è CATIONE potassio
ESERCIZIO 2
Dai il nome ad Sn+4
- stagno
- sale stannoso
- anione stagno
- catione stagno(IV)
soluzione
Anche in questo caso abbiamo tolto dall’atomo neutro 4 elettroni cioè 4 cariche negative. Ciò che ne risulta è un CATIONE con 4 cariche positive.Il nome corretto è CATIONE stagno(4) . Quando un elemento può assumere più cariche come nel caso dello stagno che può avere carica +4 o +2, il numero delle cariche positive deve sempre essere indicato dopo il simbolo e deve essere espresso in numero romano.
ESERCIZIO 3
dai il nome ad Sn+2
- stagno 2
- anione stagno 2
- stagno
- catione Stagno (II)
soluzione
poiché lo stagno ha 2 cariche positive si tratta del catione stagno quindi il nome corretto è Catione stagno(II)
ESERCIZIO 3
dai il nome a Hg2+2
- mercurio
- anione mercurio
- catione mercurio(II)
- catione mercurio(I)
soluzione
in questo simbolo due atomi di mercurio possiedono 2 cariche positive. Il mercurio può assumere carica +1 o +2. In questo caso si tratta del catione mercurio ma la carica del mercurio Hg è 2/2 =1 perché sono 2 cariche distribuite una su un atomo di Hg e l’altra sull’altro atomo. Il nome è catione mercurio(I)
ESERCIZIO 4
dai il nome a Br–
- catione bromo
- anione bromo
- anione bromuro
- anione bromidrico
soluzione
si tratta di un anione perché il Bromo Br possiede una carica negativa. Il nome corretto è anione bromuro
ESERCIZIO 5
DAI IL NOME AI SEGUENTI IONI:
Ag+ Cl- Na+ Li+ Ca+2 Mg+2 Fe+3 Fe+2 S-2
soluzione
Catione Argento , anione cloruro, catione sodio, catione litio, catione potassio catione magnesio, catione Ferro(III) catione ferro(II), anione solfuro
Gli atomi sono stati raggruppati in gruppi con caratteristiche chimiche simili dal russo Mendelaiev che ha creato la TAVOLA PERIODICA che porta il suo nome, ma che per onor del vero, è stata costruita nello stesso periodo storico anche dal tedesco Mayer.
.
